
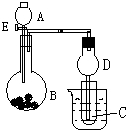
 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中:分析 (1)若A为浓硫酸;B为第三周期金属元素的片状单质,在常温下与冷水反应现象不明显,应为Mg;C为品红溶液.观察到品红溶液褪色,说明生成二氧化硫气体;
(2)碳酸酸性比苯酚强,二氧化碳可与苯酚钠溶液反应生成苯酚;
(3)观察到试管壁出现光亮的银镜,说明C中生成银氨溶液,则A应为浓氨水,在生石灰作用下生成氨气,氨气与硝酸银溶液反应生成银氨溶液,银氨溶液与乙醛在加热条件下反应生成银镜.
解答 解:(1)若A为浓硫酸;B为第三周期金属元素的片状单质,在常温下与冷水反应现象不明显,应为Mg;C为品红溶液.观察到品红溶液褪色,说明生成二氧化硫气体,反应的方程式为Mg+2H2SO4(浓)═MgSO4+SO2↑+2H2O,二氧化硫的漂白性具有可逆性,加热可恢复原来的颜色,
故答案为:Mg+2H2SO4(浓)═MgSO4+SO2↑+2H2O;溶液又呈红色;
(2)碳酸酸性比苯酚强,二氧化碳可与苯酚钠溶液反应生成苯酚,方程式为C6H5O-+H2O+CO2→C6H5OH+HCO3-,加热时,苯酚的溶解度增大,溶于水,可观察到溶液变澄清,
故答案为:C6H5O-+H2O+CO2→C6H5OH+HCO3-;浑浊变澄清;
(3)观察到试管壁出现光亮的银镜,说明C中生成银氨溶液,则A应为浓氨水,在生石灰作用下生成氨气,氨气与硝酸银溶液反应生成银氨溶液,银氨溶液与乙醛在加热条件下反应生成银镜,
故答案为:氨水; AgNO3.
点评 本题考查较为综合,涉及物质的性质探究以及制备等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的原理、方法,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与硝酸在一定条件下反应生成硝基苯;乙烯与溴的四氯化碳溶液反应 | |
| C. | 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,水层褪色;乙烯与溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl原子结构示意图: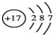 | B. | H2O2的电子式: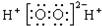 | ||
| C. | HClO的结构式H-O-Cl | D. | 14C的原子结构示意图: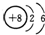 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期的所有金属离子中,Y的离子半径最小 |
| Z | Z与Y同周期,是所在周期中原子半径最小的元素 |
| T | T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
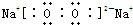 ,该化合物中所含的化学键有离子键、共价键(填化学键名称).
,该化合物中所含的化学键有离子键、共价键(填化学键名称).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com