
| A. | Li | B. | Na | C. | F | D. | S |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
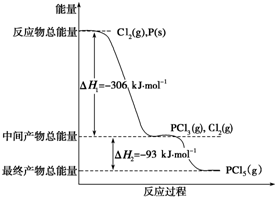 已知红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
已知红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
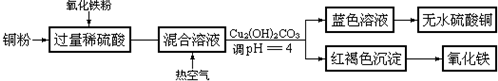
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 、
、 、
、 (任意一种);(写出其中的一种)
(任意一种);(写出其中的一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At2)为有色固体;HAt不稳定;AgAt不溶于水也不溶于稀酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是比H2S稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、MgCl2、NH4Cl | B. | H2O、Na2O、金刚石 | C. | NaCl、NaOH、H2O | D. | NH3、H2O、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z |
| A. | YZ5中各元素原子均为8电子结构 | B. | X形成的物质种类最多 | ||
| C. | X、Y、Z分别是O、P、Cl | D. | Z的单质常温下是固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 物质的燃烧一定是放热反应 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 化学能与光能之间可以相互转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com