
下列物质中,可形成酸雨的是( )
A.二氧化硫 B.氟氯代烃
C.二氧化碳 D.甲烷
科目:高中化学 来源: 题型:
科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO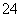 和N2H
和N2H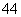 两种离子形式存在,植物的根系极易吸收N4H
两种离子形式存在,植物的根系极易吸收N4H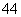 ,但它遇到碱时,会生成一种形似白磷的N4分子。N4分子 不能被植物吸收。下列有关说法不正确的是( )
,但它遇到碱时,会生成一种形似白磷的N4分子。N4分子 不能被植物吸收。下列有关说法不正确的是( )
A.N4和N2互为同素异形体
B.14N与14C互为同位素
C.N4H4(SO4)2不能与草木灰混合使用
D.8NH3+4C5OH===N4+4C5NH2+6H2+4H2O,此反应中每生成5.6 g N4时转移1.2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
如图1,溶液A中可能含有Mg2+、Cu2+、Al3+、Fe2+四种阳离子,B为淡黄色固体,旋开E后,有气体放出和白色沉淀生成,淡黄色固体的物质的量与产生沉淀的质量关系如图2。
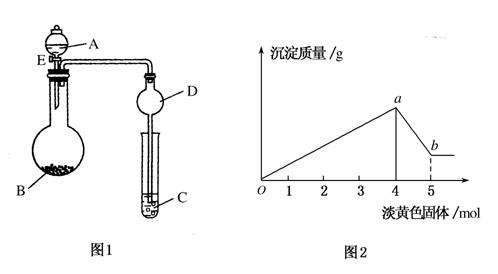
(1)则溶液中含有的阳离子有________。
(2)写出图2曲线a~b段反应的离子方程式________________,________________。
(3)A溶液中存在的阳离子的物质的量浓度之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
植物油厂为了提取大豆中丰富的油脂,下列方案设计合理的是( )
A.将大豆用水浸泡,使其中的油脂溶于水,然后再分馏
B.先将大豆压成颗粒状,再用无毒的有机溶剂浸泡,然后对浸出液进行蒸馏分离
C.将大豆用碱溶液处理,使其中的油脂溶解下来,然后再蒸发
D.将大豆粉碎,然后隔绝空气加热,使其中的油脂挥发出来
查看答案和解析>>
科目:高中化学 来源: 题型:
某市拟投资建设一个工业酒精厂,目的是用工业酒精与汽油混合制成“乙醇汽油”,以节省石油资源。已知制酒精的方法有三种:
①在催化剂作用下乙烯与水反应;
②CH3CH2Br+H2O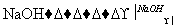 CH3CH2OH+HBr;
CH3CH2OH+HBr;
③(C6H10O5)n(淀粉)+nH2O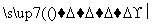 nC6H12O6(葡萄糖);
nC6H12O6(葡萄糖);
C6H12O6(葡萄糖)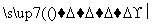 2C2H5OH+2CO2↑。
2C2H5OH+2CO2↑。
(1)方法①的化学方程式是________________________________________。
(2)方法②的化学反应类型是____________。
(3)为缓解石油短缺带来的能源危机,你认为该市应选用哪一种方法生产工业酒精?请简述理由
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4)如果从绿色化学(“原子利用率”最大化)的角度看,制酒精最好的一组方法是________。
A.① B.③
C.①③ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、B等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
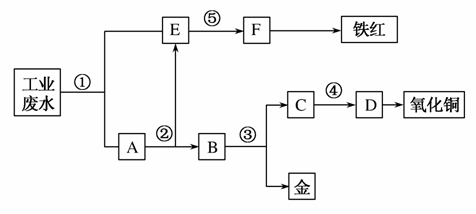
填写下面空白。
(1)图中标号处需加入的相应物质分别是①________;②________;③________;④________;⑤________。
(2)写出①处发生反应的离子方程式_____________________ _____________;写出③处发生反应的化学方程式___________。
(3)铁红的化学式为________________________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________________;氧化铜________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
50 g浓度为c mol·L-1,密度为ρ g·cm-3的氨水中加入一定量的水稀释成0.5c mol·L-1,则加入水的体积为( )
A.小于50 mL B.等于50 mL
C.大于50 mL D.等于50/ρ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。某科研小组用该原理处理污水,设计的装置如图所示。下列说法正确的是( )
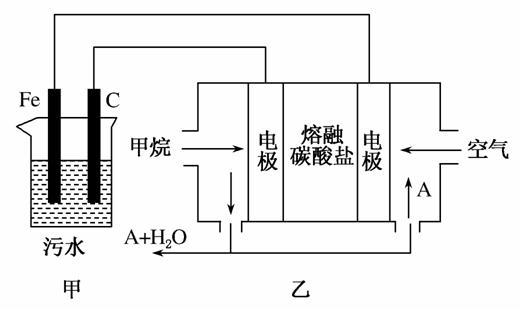
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-===Fe3+
C.为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
D.当乙装置中有1.6 g CH4参加反应时,C电极理论上生成气体的体积在标准状况下为4.48 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com