
 .
. ;
; =0.2mol,所以标准状况下,氯气体积为0.2mol×22.4L/mol=4.48L,
=0.2mol,所以标准状况下,氯气体积为0.2mol×22.4L/mol=4.48L,

科目:高中化学 来源: 题型:
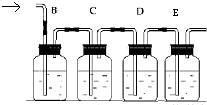 实验室用乙醇和浓硫酸加热反应制取乙烯,请回答下列问题:
实验室用乙醇和浓硫酸加热反应制取乙烯,请回答下列问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:09~10年福州八县(市)高二下学期期末联考化学卷 题型:填空题
(6分)实验室用高锰酸钾和浓盐酸反应制取氯气:K^S*5U.C#O
KMnO4+ HCl — Cl2↑+ MnCl2+ KCl+ H2O
(1)配平上述的反应方程式,并标出电子转移的方向和数目(用双线桥)
(2)其中还原剂是_______。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用高锰酸钾和浓盐酸反应制取氯气:O
KMnO4+ HCl — Cl2↑+ MnCl2+ KCl+ H2O
(1)配平上述的反应方程式,并标出电子转移的方向和数目(用双线桥)
(2)其中还原剂是_______。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是____mol。
查看答案和解析>>
科目:高中化学 来源:0110 期中题 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com