实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:☆
Ⅰ.(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为
2.1mL
2.1mL
.
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
BCAFED
BCAFED
.
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是
AC
AC
.
A.溶解后的溶液未冷至室温就转入容量瓶中;
B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时眼睛俯视刻度线;
D.定容时眼睛仰视刻度线;
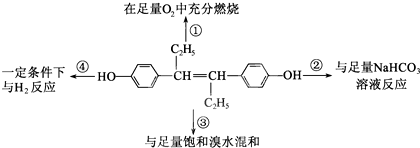
Ⅱ.(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:

①写出甲中发生反应的离子方程式:
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
②乙中盛的试剂是
饱和NaCl溶液
饱和NaCl溶液
;作用是
除去Cl2中混有的HCl气体
除去Cl2中混有的HCl气体
.
丙中盛的试剂是
浓硫酸
浓硫酸
.
(2)如果将过量二氧化锰与20mL该浓盐酸混合加热,充分反应后理论上可生成标况下的氯气的体积为
1344
1344
mL,而实际值明显少于理论值,其主要原因有:
①
部分浓盐酸挥发了
部分浓盐酸挥发了
;②
随着反应的进行浓盐酸变稀,稀盐酸不能被氧化成氯气
随着反应的进行浓盐酸变稀,稀盐酸不能被氧化成氯气
.
(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变
棕黄色
棕黄色
色,其离子方程式是
Cl2+2I-=2Cl-+I2
Cl2+2I-=2Cl-+I2
,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显
紫红色
紫红色
色,这种操作叫做
萃取
萃取
.
(4)若将制得的氯气制成饱和氯水,则实验室保存饱和氯水的方法是
保存在细口棕色试剂瓶中,放置冷暗处
保存在细口棕色试剂瓶中,放置冷暗处
.



 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
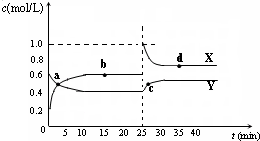 容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.

 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向. 在t℃时,向容积为2L的密闭容器甲中加入1mol A气体、3mol B气体及少量固体催化剂,发生下列反应:A(g)+3B(g)?2C(g);△H<0,10min后各物质的浓度不再变化,测得气体C的体积分数为25%.请填空:
在t℃时,向容积为2L的密闭容器甲中加入1mol A气体、3mol B气体及少量固体催化剂,发生下列反应:A(g)+3B(g)?2C(g);△H<0,10min后各物质的浓度不再变化,测得气体C的体积分数为25%.请填空: