
【题目】高纯二氧化碳主要用于医学研究及临床诊断及电子工业;含碳的有机物醇、醛在生产生活中有广泛运用。
I.(1)工业上用CO2和H2在一定条件下反应可合成二甲醚,已知:
2CO2(g)+6H2(g)=2CH3OH(g)+2H2O(g) △H1=-107.4kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2=-23.4kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
(2)在一定条件下将CO2和H2充入一固定容积的密闭容器中,在两种不同温度下发生反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
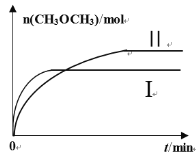
①曲线I、Ⅱ对应的平衡常数大小关系为KI_______KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是________(填序号)。
a.混合气体密度不变
b.二甲醚和水蒸气的反应速率之比保持不变
c.v正(H2)=2v逆(H2O)
d.2个C=O断裂的同时有3个H-O断裂
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
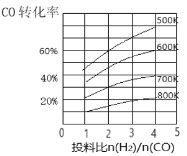
①600K温度下,将1molCO和4molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___________。
②若投料比保持不变,升高温度,该反应平衡向_______方向移动(填“正反应”或“逆反应”)。
③上述合成甲醇的过程中提高CO的转化率可采取的措施有______。(列举一种即可)。
Ⅱ.用隔膜电解法处理高浓度乙醛废水的原理为:
使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极产生气体的电极反应为:______。
②在实际工艺处理过程中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为400mg/L的废水,可得到乙醇________kg(计算结果保留2位小数)。
【答案】-130.8 < cd 0.12mol/(L·min) 逆反应 增大压强、降低温度、分离出甲醇、增大氢气的浓度等 2H2O-4e-=O2+4H+或4OH--4e-=O2+2H2O 0.33
【解析】
I.(1)2CO2(g)+6H2(g)=2CH3OH(g)+2H2O(g) △H1=-107.4kJ/mol ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2=-23.4kJ/mol ②
利用盖斯定律,将①+②得:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=(-107.4)+(-23.4)kJ/mol=-130.8 kJ/mol。答案为:-130.8;
CH3OCH3(g)+3H2O(g) △H3=(-107.4)+(-23.4)kJ/mol=-130.8 kJ/mol。答案为:-130.8;
(2)①从曲线中可以看出,曲线I先达平衡,则曲线I的温度高,此时n(CH3OCH3)小,则升高温度平衡逆向移动,正反应为放热反应,所以曲线I、Ⅱ对应的平衡常数大小关系为KI<KⅡ。
②a.因为混合气体的体积不变、质量不变,所以混合气体密度始终不变,密度不变时不一定达平衡状态,a不符合题意;
b.二甲醚和水蒸气都是生成物,二者的反应速率之比始终等于化学计量数之比,速率之比保持不变时,不一定达平衡状态,b不符合题意;
c.v正(H2)=2v逆(H2O)时,反应方向相反,速率之比等于化学计量数之比,反应达平衡状态,c符合题意;
d.2个C=O断裂,同时有3个H-O断裂,则表明若有2个CO2分子参加反应,则同时有3个H2O发生反应,反应的方向相反,则变化量之比等于化学计量数之比,反应达平衡状态,d符合题意;故选cd。答案为:<;cd;
(3)①600K温度下,将1molCO和4molH2充入2L的密闭容器中,此时投料比为4,CO的转化率为60%,参加反应的CO物质的量为0.6mol,则生成H2的物质的量为1.2mol,5min后反应达到平衡状态,则0~5min内的平均反应速率v(H2)=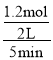 =0.12mol/(L·min)。
=0.12mol/(L·min)。
②若投料比保持不变,升高温度,CO的转化率减小,表明该反应平衡向逆反应方向移动。
③上述合成甲醇的反应,是放热的、体积缩小的可逆反应,所以提高CO的转化率可采取的措施有增大压强、降低温度、分离出甲醇、增大氢气的浓度等。
答案为:0.12mol/(L·min);逆反应;增大压强、降低温度、分离出甲醇、增大氢气的浓度等;
Ⅱ.①电解Na2SO4溶液的实质是电解水,电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极为H2O失电子生成H+和O2,或OH-失电子生成O2和H2O,产生气体的电极反应为:2H2O-4e-=O2+4H+或4OH--4e-=O2+2H2O。
②在阴极区,发生反应为:2H2O+2e-=2OH-+H2↑,CH3CHO+H2→CH3CH2OH,在实际工艺处理过程中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为400mg/L的废水,则阴极可得到乙醇的质量为![]() =0.33kg。答案为:2H2O-4e-=O2+4H+或4OH--4e-=O2+2H2O;0.33。
=0.33kg。答案为:2H2O-4e-=O2+4H+或4OH--4e-=O2+2H2O;0.33。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】室温下,向10.00mL0.1000mol·L-1HCl和0.1000mol·L-1CH3COOH的混合溶液中滴入0.1000mol·L-1NaOH溶液,溶液pH的变化曲线如图所示。已知:常温下,Ka(CH3COOH)=1.75×10-5。下列叙述错误的是
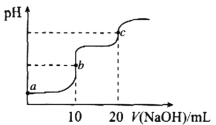
A.a点所示溶液中,CH3COOH的电离度约为1.75×10-2%
B.a、b、c三点所示溶液中,水的电离程度最大的是c点
C.c点所示溶液中:c(Na+)>c(C1-)>c(CH3COOH>c(OH-)>c(H+)
D.加热b点所示溶液,![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料。请用离子方程式来证明它是一种两性氧化物:____________、___________.
(2)取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁、铝的物质的量之比为___________。
(3)将一定质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.则盐酸的物质的量浓度(假设反应前后溶液体积的变化忽略不计)_______________.产生沉淀质量的最大值_____________g.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象和结论都正确的是
实验 | 现象 | 结论 |
A.充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不能燃烧 | Na2SiO3可做防火剂 |
B.测定浓度均为0.1 mol·L-1的CH3COONa与HCOONa溶液的pH | CH3COONa溶液的pH较大 | 结合H+的能力: HCOO->CH3COO- |
C.某溶液中加浓NaOH溶液加热 | 产生能使湿润的蓝色石蕊试纸变红色的气体 | 原溶液中有 |
D.将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.糖类、油脂和蛋白质都是天然高分子化合物
B.苯、苯乙炔、甲苯、苯酚分子中所有原子都共平面
C.分子式为C5H12O且能与钠反应产生氢气的有机物的同分异构体有8种
D.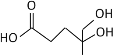 是乙酸的同系物,能和碳酸钠反应
是乙酸的同系物,能和碳酸钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米微晶![]() (碱式碳酸锌)属于高端精细化工产品,晶粒粒度在
(碱式碳酸锌)属于高端精细化工产品,晶粒粒度在![]() ,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为
,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为![]() ,含少量
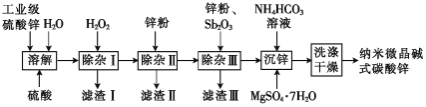
,含少量![]() )制备纳米微晶碱式碳酸锌样品的流程如图所示:
)制备纳米微晶碱式碳酸锌样品的流程如图所示:
已知:a.![]() 的
的![]() 分别是37.4、15.4、16.2。
分别是37.4、15.4、16.2。
b.残留在溶液中的离子浓度小于![]() 时可认为沉淀完全。
时可认为沉淀完全。
c.滤渣Ⅲ所含主要金属元素是![]() 。
。
(1)“除杂Ⅰ”的目的是除去溶液中的铁元素,则![]() 的作用是________________;若溶液中
的作用是________________;若溶液中![]() ,此过程中还应调节溶液的
,此过程中还应调节溶液的![]() 在____范围(不考虑离子间的相互影响)。
在____范围(不考虑离子间的相互影响)。
(2)“除杂Ⅱ”与“除杂Ⅲ”均为还原除杂。
①滤渣Ⅱ的主要金属元素是_________________________
②“除杂Ⅲ”中加入的![]() 在溶液中主要以
在溶液中主要以![]() 形式存在。请写出锌与
形式存在。请写出锌与![]() 反应生成“金属间化合物”
反应生成“金属间化合物”![]() (
(![]() 中各元素化合价视为0价)的离子方程式:___________________________
中各元素化合价视为0价)的离子方程式:___________________________
(3)“沉锌”后得到的固体先用去离子水洗涤,再用乙醇洗涤。用乙醇洗涤的目的是_______________________
(4)加入![]() 的主要目的是降低样品晶粒粒度,但主元素
的主要目的是降低样品晶粒粒度,但主元素![]() 的质量分数必须在56%以上。若镁、锌的质量比值过高,
的质量分数必须在56%以上。若镁、锌的质量比值过高,![]() 还可能会生成_________(填化学式),从而对样品造成影响。
还可能会生成_________(填化学式),从而对样品造成影响。
(5)样品中锌的含量可用![]() (可表示为
(可表示为![]() )滴定测定,反应的离子方程式为
)滴定测定,反应的离子方程式为![]() 。取
。取![]() 纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用
纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用![]() 标准溶液滴定,消耗
标准溶液滴定,消耗![]() 溶液
溶液![]() ,则样品中锌的质量分数是_______(用代数式表示)。
,则样品中锌的质量分数是_______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() 先将
先将![]() 溶于水制成
溶于水制成![]() 溶液,然后取出
溶液,然后取出![]() 溶液滴加
溶液滴加![]() 溶液,整个过程中利用
溶液,整个过程中利用![]() 数据采集器测得溶液的
数据采集器测得溶液的![]() 变化曲线如图所示(实验过程中不考虑
变化曲线如图所示(实验过程中不考虑![]() 的挥发和
的挥发和![]() 的分解)。下列说法正确的是
的分解)。下列说法正确的是

A.![]() 过程中,是氯气溶于水的过程,
过程中,是氯气溶于水的过程,![]() 和水的电离程度均不断增大
和水的电离程度均不断增大
B.![]() 点溶液中
点溶液中![]() 接近于
接近于![]()
C.![]() ,溶液中
,溶液中![]()
D.滴加![]() 溶液的体积为
溶液的体积为![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,向废液中加入Na2SO3溶液反应后进行分离除去CCl4,再向反应液中通入Cl2进行氧化、富集等系列操作获得碘单质。下列说法不正确的是:
A.加入Na2SO3溶液发生的氧化还原反应为:SO32-+I2+H2O=SO42-+2I-+2H+
B.氧化时应控制在较低温度(40℃左右),可增大Cl2的溶解度并减少I2的损失
C.分离除去CCl4的操作为萃取,应在分液漏斗中进行
D.工业上常在干海带浸泡液中通入适量氯气,再采用过滤的方法得到粗碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到实验目的的是
A | B | C | D |
|
|
|
|
分离乙酸乙酯与饱和碳酸钠溶液 | 除去乙炔中的硫化氢 | 检验反应生成的气体中含有乙烯 | 酸性:醋酸>碳酸>硼酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com