
【题目】将钠、镁、铝各0.3 mol分别放入足量的盐酸中,同温同压下产生的气体的体积比是( )
A.1∶1∶1 B.1∶2∶3 C.6∶3∶2 D.3∶1∶1
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工艺流程图,判断下列说法正确的是 ( )
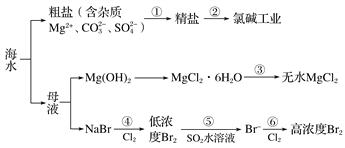
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 工业上采用向母液中加入烧碱的方法获得氢氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3·H2O及FeO等杂质。回收废酸同时生产含铁产品的流程如下:
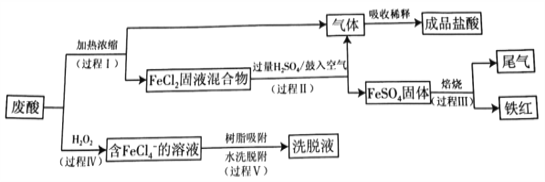
已知:
i.酸洗钢制构件后得到废酸的主要成分如下表所示。
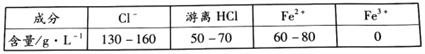
ii.pH <4时,Fe2+不易被氧气氧化。
(1)用离子方程式解释废酸中不含Fe3+的原因______________________________。
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq) ![]() FeSO4(s)+2HCl( aq)。
FeSO4(s)+2HCl( aq)。
①加入过量H2SO4的作用是__________________________________(写出一点即可)。
②用化学平衡原理解释鼓入空气的目的:_________________________________。
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是_________________________________________。
(4)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH +X-![]() RX +OH-(X-表示FeCl4-)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-
RX +OH-(X-表示FeCl4-)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-![]() Fe3+ +4C1-。
Fe3+ +4C1-。
①吸附后溶液的pH将会_______________。(填“升高”、“降低”或“不变”)
②洗脱液经处理后有许多用途,下列用途合理的是_________________。
A、刻蚀印刷铜线路板 B、净化污水 C、自来水消毒 D、浸泡生物标本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:3B(s)![]() 2C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
2C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变②混合气体的密度不变③C(g)的物质的量浓度不变④容器内C、D三种气体的浓度之比为2:1⑤单位时间内生成n molD,同时生成2n mol C.⑥单位时间内生成2n molC,同时消耗n mol D.⑦混合气体中C的体积分数不变
A. ①②③ B. ③④⑥ C. ①②③⑥⑦ D. ①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列措施中能够同时满足增大反应速率和提高CO转化率的是________(填字母)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应混合物中分离出来
(3)采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g)![]() CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
①合成甲醇的反应为______(填“放热”或“吸热”)反应。

②A、B、C三点的平衡常数KA、KB、KC的大小关系为__________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_______________L。
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。X原子最外层比次外层多3个电子;Y、Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的最高价氧化物在无机含氧酸中酸性最强。下列说法正确的是
A. X的气态氢化物的热稳定性比氧的强
B. 元素Z、W的简单离子具有相同的电子层结构
C. Y、Z、W的最高价氧化物对应的水化物之间能相互反应
D. 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对增生性瘢痕早期进行 ![]() Sr(锶)干预可取得较好效果.下列说法正确的是( )
Sr(锶)干预可取得较好效果.下列说法正确的是( )
A.Sr为于第4周期ⅡA 族
B.![]() Sr核内中子数与质子数之差为14
Sr核内中子数与质子数之差为14
C.![]() Sr与
Sr与 ![]() Y互为同位素
Y互为同位素
D.![]() Sr的核内质子数为38,Sr元素的相对原子质量为90
Sr的核内质子数为38,Sr元素的相对原子质量为90
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com