
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
分析 金属的金属性越强,其单质的还原性越强;在原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;在金属活动性顺序表中,位于氢之前的金属能置换出酸中的氢,据此分析解答.
解答 解:金属的金属性越强,其单质的还原性越强;在原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;在金属活动性顺序表中,位于氢之前的金属能置换出酸中的氢,
①水溶液中X+Y2+═X2++Y,说明活动性X>Y;
②Z+2H2O(冷水)═Z(OH)2+H2↑,能与冷水反应生成氢气说明Z金属性活动性很强;
③M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-═M2+,M失电子发生氧化反应,则M是负极、N是正极,活动性M>N;
④Y可以溶于稀硫酸中,M不被稀硫酸氧化,说明活动性Y>M,
通过以上分析知,金属活动性顺序N<M<Y<X<Z,
故选C.
点评 本题考查金属活动性强弱顺序判断,为高频考点,利用金属与酸或水反应置换出氢气难易程度、金属最高价氧化物的水化物碱性强弱、金属之间的置换反应等可以判断金属性强弱,注意不能根据失电子多少判断,为易错点,题目难度中等.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
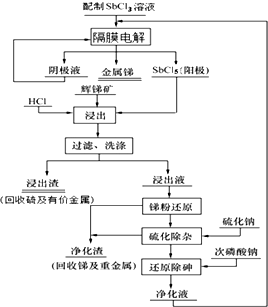 我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图:
我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(Cl-)>c(H+)>c(NH4+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | D. | c(OH-)>c(H+)>c(Cl-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com