
| A. | r(S2-)>r(O2-)>r(F-) | B. | r(Al)>r(Mg)>r(Na) | C. | r(Na+)>r(O2-)>r(F-) | D. | r(Na)>r(Na+)>r(Cl-) |
分析 A.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.同周期自左而右原子半径减小;
C.电子层结构相同的离子,核电荷数越大离子半径越小;
D.电子层越多离子半径越大.
解答 解:A.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(S2-)>r(O2-)>r(F-),故A正确;
B.同周期自左而右原子半径减小,故原子半径:r(Al)<r(Mg)<r(Na),故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(F-)>r(Na+),故C错误;
D.电子层越多离子半径越大,故离子半径:r(Na+)<r(Cl-),故D错误,
故选A.
点评 本题考查微粒半径比较,比较基础,明确半径比较规律即可解答,注意对元素周期律的理解.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3. | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 与水和酒精等混溶 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 与水和酒精等混溶 |
| A. | 蒸馏法 | B. | 萃取法 | ||
| C. | “溶解、结晶、过滤”的方法 | D. | 分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
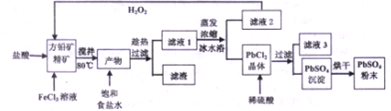
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HClO3>H2SO3>H3PO4 | B. | 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性HCl>H2S>PH3 | D. | 氧化性Na+>Mg2+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
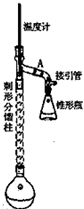 乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛是一种有刺激性气味的气体 | |
| B. | 石油通过裂解可以得到更多的汽油,可以满足工业需求 | |
| C. | 乙醇易溶于水是因为含有羟基 | |
| D. | 氟氯代烷产生的自由基可以作为催化剂使O3转化为O2,从而破坏臭氧层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com