
分析 (1)根据n=$\frac{m}{M}$,c=$\frac{n}{v}$求NaClO溶液的物质的量浓度
(2)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,S元素化合价由-$\frac{2}{X}$升高为+6,而NaClO被还原为NaCl,Cl元素化合价由+1价降低为-1价,根据电子转移守恒,列方程计算x的值.
解答 解:(1)n(NaClO)=$\frac{11.92g}{74.5g/mol}$=0.16mol,c(NaClO)=$\frac{n(NaClO)}{V}$=$\frac{0.16}{0.1}$=1.6mol/l,故答案为:1.6;
(2)0.01molNa2Sx在碱性溶液中可被NaClO氧化为Na2SO4,S元素化合价由-$\frac{2}{X}$升高为+6,则n失(电子)=(6+$\frac{2}{x}$)x×0.01,而0.16molNaClO被还原为NaCl,Cl元素化合价由+1价降低为-1价,则n得(电子)=(1-(-1))×0.16=0.32
根据得失电子守恒得(6+$\frac{2}{x}$)x×0.01=0.32
解得:x=5,故答案为:5.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意元素化合价的判断,为解答该题的关键,从元素化合价的角度解答该类题目,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
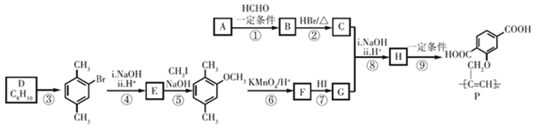
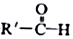 $\stackrel{一定条件}{→}$R-C≡
$\stackrel{一定条件}{→}$R-C≡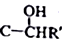
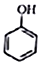 +CH2I$\stackrel{NaOH}{→}$
+CH2I$\stackrel{NaOH}{→}$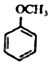 +NaI+H2O
+NaI+H2O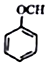 +HI→
+HI→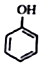 +CH2I
+CH2I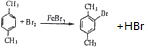 .
.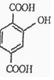 .
.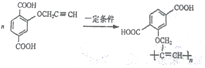 .
.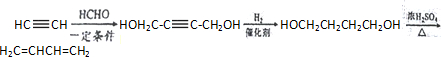 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
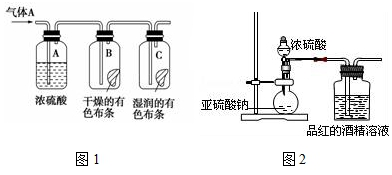
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 光照甲烷和氯气的混合气体后,瓶壁上有油状液滴附着 | |
| C. | 苯滴加到溴水中,震荡后水层接近无色 | |
| D. | 在葡萄糖溶液中加入新制的氢氧化铜,加热后产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
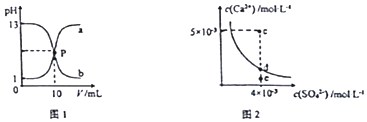
| A. | 图1中P点溶液:c(Na+ )=c(Cl-)>c(H+ )=c(OH- ) | |
| B. | 由图1可知盐酸和NaOH溶液的浓度均为1mol•L-1 | |
| C. | 图2中c点有沉淀生成,达平衡后溶液中c(SO42- )=3×10-3 mol•L-1 | |
| D. | 可通过蒸发将图 2中e点的溶液变到d点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com