
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
分析 (1)①已知:Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1
Ⅱ.N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
Ⅲ.H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ•mol-1
根据盖斯定律,Ⅲ×6+Ⅱ×2-Ⅰ×2可得:4NH3(g)+5O2(g)═4NO(g)+6H2O(l),反应热也进行相应计算;
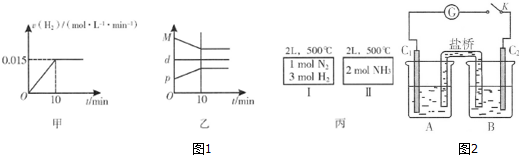
②A.用H2表示的反应速率为一段时间内平均速率,不是即时速率;
B.混合气体总质量不变,容器容积不变,混合气体密度为定值,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,至平衡时不再变化,压强也随反应进行减小,至平衡时不再变化;
C.丙的两个容器中温度均相同,分别发生反应:N2(g)+3H2(g)?2NH3(g)、2NH3(g)?N2(g)+3H2(g),两个反应的平衡常数互为倒数,且为完全等效平衡,平衡时相同组分的浓度相等;
(2)①正反应为吸热反应,升高温度平衡向正反应移动;
②250s处于平衡状态,计算平衡时各组分浓度,代入平衡常数表达式K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$计算;
(3)①As处于第三周期VA族;
②B中滴加浓盐酸时发生AsO43-+2I-+2H+?AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO42-+2H++2e-=AsO32-+H2O,灵敏电流计G的指针向右偏转,说明指针偏向电流流入方向,向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,导线中电流由左向右.
解答 解:(1)①已知:Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1
Ⅱ.N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
Ⅲ.H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ•mol-1
根据盖斯定律,Ⅲ×6+Ⅱ×2-Ⅰ×2可得:4NH3(g)+5O2(g)═4NO(g)+6H2O(l),△H=
6×(-285.8kJ•mol-1)+2×180kJ•mol-1-2×(-92.2kJ•mol-1)=-1170.4kJ•mol-1,
故答案为:-1170.4kJ•mol-1;
②A.用H2表示的反应速率为一段时间内平均速率,不是即时速率,而图甲中为即时速率,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体密度为定值,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,至平衡时不再变化,压强也随反应进行减小,至平衡时不再变化,故B错误;
C.丙的两个容器中温度均相同,分别发生反应:N2(g)+3H2(g)?2NH3(g)、2NH3(g)?N2(g)+3H2(g),两个反应的平衡常数互为倒数,且为完全等效平衡,平衡时相同组分的浓度相等,故C正确,
故选:C;
(2)①正反应为吸热反应,升高温度平衡向正反应移动,故答案为:正向;
②250s处于平衡状态,平衡时PCl3为0.2mol,则:
PCl5(g)?PCl3(g)+Cl2(g)
起始量(mol):1 0 0
变化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.2 0.2
平衡常数K=$\frac{c(PC{l}_{3})×c(C{l}_{2})}{c(PC{l}_{5})}$=$\frac{\frac{0.2}{2}×\frac{0.2}{2}}{\frac{0.8}{2}}$=0.025,
故答案为:0.025;
(3)①As处于第四周期VA族,故答案为:第四周期VA族;
②B中滴加浓盐酸时发生AsO43-+2I-+2H+?AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为:AsO42-+2H++2e-=AsO32-+H2O,灵敏电流计G的指针向右偏转,说明指针偏向电流流入方向,向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,导线中电流由左向右,可观察到电流计指针向左偏,
故答案为:AsO42-+2H++2e-=AsO32-+H2O;向左偏.
点评 本题考查化学平衡计算与影响因素、反应热计算、原电池等,(3)中注意根据平衡移动原理分析发生的反应,难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的固定是指将氮元素由游离态转化为化合态的过程.
氮的固定是指将氮元素由游离态转化为化合态的过程.| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备溴苯的实验步骤如下:
实验室制备溴苯的实验步骤如下: +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.| 苯 | 溴苯 | 对二溴苯 | |
| 密度/gcm-3 | 0.88 | 1.50 | 1.96 |
| 沸点/℃ | 80 | 156 | 220 |
| 水溶性 | 微溶 | 微溶 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p1${\;}^{2{2}^{3}}$③1s22s22p2④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p 2 ③3s23p3 ④33s23p 4第一电离能最大是③ | |
| C. | ①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4发生还原反应,白磷只作还原剂 | |
| B. | 氧化产物和还原产物的物质的量之比为6:5 | |
| C. | P4是一种正四面体型分子,每个P4分子中含有6个P-P非极性键 | |
| D. | 该反应中被硫酸铜氧化的白磷P4有3 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com