
| A. | 电离程度 | B. | 醋酸的电离常数 | ||
| C. | 中和时所需NaOH的物质的量 | D. | CH3COOH的物质的量 |
分析 醋酸为弱电解质,溶液浓度越大,电离程度越小,醋酸的电离常数只与温度有关,以此解答该题.
解答 解:A.醋酸为弱电解质,溶液浓度越大,电离程度越小,电离程度前者大于后者,故A正确;
B.醋酸的电离常数只与温度有关,与浓度无关,温度相同,所以电离常数相同,故B错误;
C.两溶液中醋酸的物质的量,n(前)=c1•V1=0.1 L×0.01 mol•L-1=1×10-3 mol,n(后)=c2•V2=0.01 L×0.1 mol•L-1=1×10-3 mol,两者相等,因而中和时消耗的NaOH的量相等,故C错误;
D.两溶液中醋酸的物质的量,n(前)=c1•V1=0.1 L×0.01 mol•L-1=1×10-3 mol,n(后)=c2•V2=0.01 L×0.1 mol•L-1=1×10-3 mol,两者中CH3COOH的物质的量相等,故D错误.
故选A.
点评 本题考查弱电解质的电离,题目难度不大,注意把握弱电解质的电离特点,侧重于考查学生的分析能力.


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序:Z、W、Y | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y、R | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | R的最高价氧化物对应的水化物化学式一定是HRO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 白磷的燃烧热为E2-E1 | |
| B. | 白磷分子中磷原子的杂化方式为sp3 | |
| C. | 1molP4O10中σ键的数目为16NA | |
| D. | 假设P-P、P-O、O=O的键能分别为a、b、c,则P=O的健能为(6a+5c-12b)/4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定盛待测液的锥形瓶中有少量水对滴定结果无影响,锥形瓶不能用待测液润洗 | |
| B. | 酸式和碱式滴定管用蒸馏水洗净后还需用标准液或待测液润洗 | |
| C. | 滴定时左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管的液面 | |
| D. | 称量氯化钠固体,氯化钠放在称量纸上,置于托盘天平的左盘,砝码放在天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量烧碱固体 | B. | 升高温度 | ||
| C. | 加少量冰醋酸 | D. | 加少量醋酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022mol•L-1,则反应的△H<0 | |
| B. | 反应在前2s的平均速率v(CO)=0.015mol•L-1•S-1 | |
| C. | 保持其他条件不变,起始向容器中充入0.12molCOCl2和0.060molCl2、0.060 molCO,反应达到平衡前的速率:v正<v逆 | |
| D. | 保持其他条件不变,起始向容器中充入0.10molCl2和0.08molCO,达到平衡时,Cl2的转化小于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
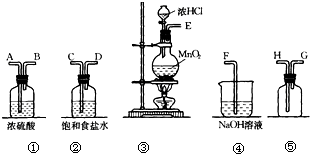
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
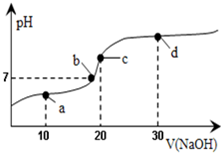 20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )
20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )| A. | a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | ||
| C. | c点:c(H+)=c(CH3COOH)+c(OH-) | D. | d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 常温常压下,23 g NO2含有NA个氧原子 | |
| D. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com