
| A. | 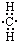 | B. | 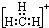 | C. | 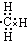 | D. | 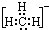 |
科目:高中化学 来源: 题型:选择题
| A. | 铜器出现铜绿 | B. | 铁制菜刀生锈 | ||
| C. | 大理石雕像被酸雨腐蚀毁坏 | D. | 铝锅表面生成致密的薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质类别 | 具体物质 | 物质类别 | 具体物质 |
| 压缩气体和液化气体 | 氩气、压缩天然气易燃固体、自然物品和遇湿易燃物品 | 硫磺、硝化纤维素、电石、硅钙合金、钠、钾 | |
| 氧化剂和有机过氧化物 | 硝酸钾、硝酸钠、过氧乙酸 | 易燃液体 | 甲乙酮、乙酸乙酯 |
| 腐蚀品、杂类 | 甲酸、磷酸、甲基磺酸、烧碱、硫化碱 | 毒害品 | 氰化钠、甲苯二异氰酸酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀 | |
| B. | 操作②、操作③分别是过滤与蒸发结晶 | |
| C. | 反应①加料之前需将反应器加热至100℃以上并通入氩气 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3:2 | B. | 3:2:2 | C. | 5:4:1 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
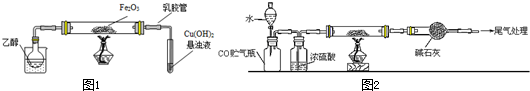
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA | |
| B. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com