

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |

分析 (1)根据装置图可知装置b的名称;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应生成二环己醚;
(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出;
(5)无水氯化钙用于吸收产物中少量的水;
(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管;
(7)环己醇为0.2mol,根据反应方程式,理论上可以得到0.2mol环己烯,其质量为16.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算
解答 解:(1)依据装置图分析可知装置b是蒸馏装置中的冷凝器装置,
故答案为:直形冷凝器;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,故选B,
故答案为:防止暴沸;B;
(3)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚为 ,
,
故答案为: ;
;
(4)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出,
故答案为:检漏;上口倒出;
(5)分离提纯过程中加入无水氯化钙的目的是利用无水氯化钙吸收产物中少量的水,
故答案为:干燥;
(6)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管,
故选:CD;
(7)环己醇为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,所以产率=$\frac{10g}{16.4g}$×100%=61%,
故选C.
点评 本题考查了物质制备实验方案设计,醇性质的分析应用,实验现象和原理的分析判断,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 被测样品中含有加热不挥发的杂质 | B. | 被测样品中含有加热易挥发的杂质 | ||
| C. | 实验前被测样品已有部分失水 | D. | 加热前所用的坩埚未完全干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 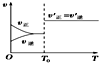 反应H2(g)+I2(g)?2HI(g)达到平衡后,升高温度时反应速率随时间的变化 | |
| B. | 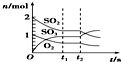 反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,缩小容器容积时各成分的物质的量随时间的变化 | |
| C. |  反应N2(g)+3H2(g)?2NH3(g)在恒温条件下,反应速率与压强的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤①③④ | B. | ①③⑤②④ | C. | ①②③④⑤ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
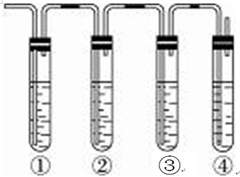 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②⑤⑥⑧ | C. | ②③⑥⑧ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第一电离能由大到小的顺序为O>N>C | |
| B. | NO3-中N采用sp2杂化,故NO3-的空间构型为三角锥形 | |
| C. | 由于C22-和O22+为等电子体,所以可以判断O22+的电子式为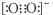 | |
| D. | 液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com