
| A. | 硫磺 | B. | 苯酚 | C. | 硼酸 | D. | 甲醛 |
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| C. | 20ml 0.1mol/L CH3COONa溶液与10ml HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
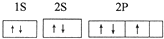
 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 活泼非金属单质在氧化还原反应中只作氧化剂 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 含有某元素最高价态的化合物不一定具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入少量SO2,溶液漂白性增强 | |
| B. | 加入少量NaHCO3固体,c(ClO)减小 | |
| C. | 加入少量水,水的电离平衡向正方向移动 | |
| D. | 加入NaOH固体至恰好完全反应,一定有c(Na+)=c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com