
| 步骤 | 实验方案 | 实验现象(描述最后的) | 离子方程式 |
| ① | 先向试管中加入溴化钠溶液2ml,再加入4-5滴新制氯水,振荡后分两份,取一份又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为橙色 | Cl2+2Br-=Br2+2Cl- |
| ② | 取少量KI溶液于试管,加入几滴步骤①留下的另一份溶液,振荡,又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为紫红色 | Br2+2I-=I2+2Br- |
| 结论 | 氧化性:Cl2>Br2>I2(非金属性:Cl>Br>I) | ||
分析 (1)K的密度小于水、熔点较低,K和水剧烈反应且放出大量热并生成氢气,K元素焰色反应呈紫色;金属的金属性越强,其单质与水或酸反应越剧烈;
(2)①氯气的氧化性大于溴,氯气和溴离子发生氧化还原反应生成溴,溴的四氯化碳溶液呈橙色,四氯化碳和水不互溶,且密度大于水,溴在四氯化碳中溶解度大于水;
②溴的氧化性大于碘,向KI溶液中滴加少量含有溴的溶液,溴和碘离子发生置换反应生成碘,碘易溶于四氯化碳而使其溶液呈紫色.
解答 解:(1)K的密度小于水、熔点较低,K和水剧烈反应且放出大量热并生成氢气,K元素焰色反应呈紫色,所以将K放入水中看到的现象为钾迅速熔化成一小球,四处游动,发出轻微爆炸声,有紫色火焰产生;反应方程式为2K+2 H2O=2KOH+H2↑;金属的金属性越强,其单质与水或酸反应越剧烈,K的金属性大于Na,所以K与水反应剧烈程度大于Na,
故答案为:钾迅速熔化成一小球,四处游动,发出轻微爆炸声,有紫色火焰产生;2K+2 H2O=2KOH+H2↑;
剧烈;
(2)①氯气的氧化性大于溴,氯气和溴离子发生氧化还原反应生成溴,溴的四氯化碳溶液呈橙色,四氯化碳和水不互溶,且密度大于水,溴在四氯化碳中溶解度大于水,所以看到的现象是上层为浅黄色(或无色),下层为橙色,离子方程式为,
故答案为:上层为浅黄色(或无色),下层为橙色;Cl2+2Br-=Br2+2 Cl-;
②溴的氧化性大于碘,向KI溶液中滴加少量含有溴的溶液,溴和碘离子发生置换反应生成碘,碘易溶于四氯化碳而使其溶液呈紫色,所以其操作方法是取少量KI溶液于试管,加入几滴步骤①留下的另一份溶液,振荡,又加入CCl4,振荡、静置;看到的现象是上层为浅黄色(或无色),下层为紫红色;离子方程式为Br2+2I-=I2+2 Br -,
故答案为:取少量KI溶液于试管,加入几滴步骤①留下的另一份溶液,振荡,又加入CCl4,振荡、静置;上层为浅黄色(或无色),下层为紫红色;Br2+2I-=I2+2 Br-.
点评 本题以碱金属族元素、卤族元素为载体考查同一主族元素性质递变规律,侧重考查学生实验探究能力及知识运用能力,难点是实验操作步骤及现象叙述、化学用语的正确运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 有溶质析出 | B. | 溶液中Ca2+的数目不变 | ||
| C. | 溶剂的质量减小 | D. | 溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通式相同的两种有机物按不同比例混合时,只要总质量一定,完全燃烧的耗氧量就一定 | |
| B. | 除去甲烷中的乙烯可用溴水或酸性高锰酸钾溶液 | |
| C. | 糖类、油脂、蛋白质都会在一定条件下水解 | |
| D. | 戊烷有3种同分异构体,而一氯戊烷有8种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 可以利用元素周期律预测新元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 HA 中c(H+)=c(OH-)+c(A-), | |
| B. | 0.1mol•L-1 HA 与 0.1 mol•L-1NaOH 混合至溶液呈中性:c(Na+)<c(A-) | |
| C. | 0.1mol•L-1 NaA 中c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 0.1mol•L-1 HA中加入少量NaA固体,HA的电离常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
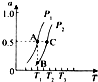
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
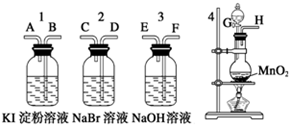 为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和淀粉KI溶液中.有如图所示的仪器(橡胶塞均为双孔)及药品,试回答:
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和淀粉KI溶液中.有如图所示的仪器(橡胶塞均为双孔)及药品,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | A | B | C | D |
| 反应前质量/g | 19.7 | 8.7 | 31.6 | 0.4 |
| 反应后质量/g | 待测 | 17.4 | 0 | 3.6 |
| A. | C一定是化合物,D可能是单质 | |
| B. | 反应过程中,B与D的质量比87:36 | |
| C. | 反应后密闭容器中A的质量为19.7g | |
| D. | 反应中A与C的化学计量数之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
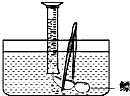 小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占$\frac{1}{4}$,其余主要是二氧化碳(二氧化碳易溶于水)和氮气.探究分两步进行.
小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占$\frac{1}{4}$,其余主要是二氧化碳(二氧化碳易溶于水)和氮气.探究分两步进行.| 验证 | 方 法 | 现 象 |
| 含氧气 | 将燃着的木条放入含有鱼鳔内气体的集气瓶中 | 木条能继续燃烧 |
| 含二氧化碳 | 在含有鱼鳔内气体的集气瓶中加入少量的澄清石灰水 | 石灰水变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com