
 CH3COO-+ H+ (1分)
CH3COO-+ H+ (1分)  CH3COOH + OH-(1分)
CH3COOH + OH-(1分) CH3COO-+H+;
CH3COO-+H+; CH3COOH+OH-,导致其溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;
CH3COOH+OH-,导致其溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;

 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:不详 题型:单选题
| A.温度控制在500℃有利于合成氨反应 | ||
| B.用排饱和食盐水法收集Cl2 | ||
| C.打开碳酸饮料会有大量气泡冒出 | ||
| D.工业制取金属钾Na(l)+KCl(l) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2SO4═2Na++SO4-2 | B.Al2(SO4)3═2Al3++3SO42- |
| C.Ba(OH)2═Ba2++(OH-)2 | D.CuSO4═Cu2++S6++4O2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.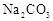 和 和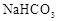 溶液中: 溶液中: |
B.一元弱碱MOH对应的盐MCl溶液中: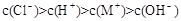 |
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中: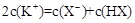 |
| D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合: |
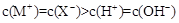
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.盐酸溶液中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 |
| B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
| D.它们分别与足量CaCO3反应时,放出的CO2一样多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.HCO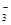 >HSO3- >HSO3- | B.CO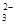 >SO >SO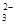 | C.HCO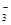 >ClO- >ClO- | D.ClO->SO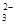 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com