
| A、23.8% |
| B、33.4% |
| C、35.6% |
| D、63.8% |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
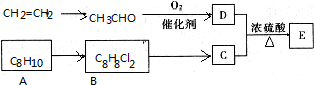
科目:高中化学 来源: 题型:
查看答案和解析>>
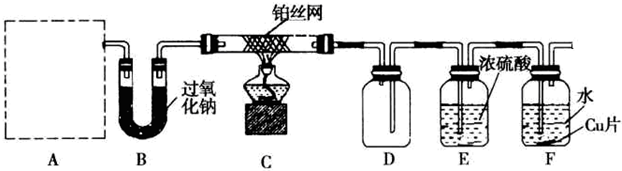
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
 B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
| CO2(mol) | 0.05 | 0.15 | 0.6 |
| NaX(mol) | |||
| Na2CO3(mol) | |||
| NaHCO3(mol) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、以下是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有4步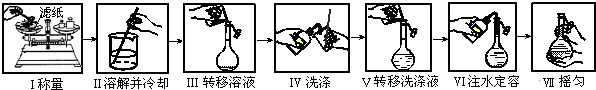 |
| B、苯的硝化实验三种溶液混合过程中,应先在试管中加入浓硝酸,再沿试管壁缓慢加入浓硫酸混合均匀,冷却到50℃以下,再在不断振荡下逐滴加入苯 |
| C、火柴头中硫元素的检测实验中,应用少量1mol?L-1较大浓度的高锰酸钾溶液来吸收SO2气体,以便于观察到褪色的明显实验现象 |
| D、在试管中加入2mL硝酸银溶液,然后加入几滴NaCl溶液,再加入几滴KI溶液,可以观察到白色沉淀变成黄色沉淀,可以说明AgI的KSP小于AgCl的KSP |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
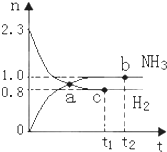 一定条件下,在绝热恒容2L密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)+Q,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )
一定条件下,在绝热恒容2L密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)+Q,若反应过程中n(H2)和n(NH3)随时间变化的关系如图所示,则下列有关叙述中一定正确的是( )| A、若在t2时刻再充入一定量He,达平衡时C(H2)<0.4mol/L |
| B、a点表示NH3生成速率与NH3分解速率相等 |
| C、b点和c点H2的转化率相等 |
| D、若在t1时刻再充入一定量H2,达平衡时化学平衡常数变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com