
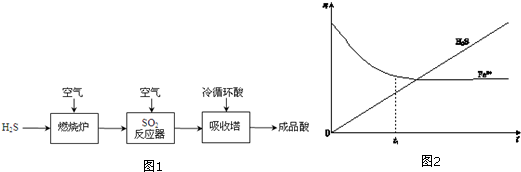
分析 (1)煤液化就是以煤为原料生产甲醇的过程,是化学变化;
(2)煤液化过程中产生的H2S可生产硫酸的流程为:煤液化过程中产生的H2S被空气中的氧气氧化成二氧化硫,二氧化硫进一步被氧化成三氧化硫,在吸收塔中冷循环酸吸收三氧化硫生成硫酸,据此答题;
(3)含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,硫化氢被铁离子氧化成单质硫,随着时间的推移,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,生成硫,所以n(Fe3+)基本不变,硫化氢不断被氧化成硫单质,据此答题.
解答 解:(1)煤液化就是以煤为原料生产甲醇的过程,是化学变化,
故答案为:化学;
(2)煤液化过程中产生的H2S可生产硫酸的流程为:煤液化过程中产生的H2S被空气中的氧气氧化成二氧化硫,二氧化硫进一步被氧化成三氧化硫,在吸收塔中冷循环酸吸收三氧化硫生成硫酸,
①SO2反应器中的化学方程式是2SO2+O2 $\frac{\underline{\;催化剂\;}}{△}$2SO3,
故答案为:2SO2+O2 $\frac{\underline{\;催化剂\;}}{△}$2SO3;
②H2O2吸收SO2的化学方程式是SO2+H2O2=H2SO4,硫酸与氯化钡反应硫酸钡bg,所以SO2的体积为$\frac{b}{233}×22.4L$,则尾气中SO2的含量(体积分数)为$\frac{\frac{b}{233}×22.4}{V}$×100%=$\frac{22.4b}{233V}$×100%,
故答案为:$\frac{22.4b}{233V}$×100%;
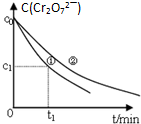
(3)含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,硫化氢被铁离子氧化成单质硫,随着时间的推移,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,生成硫,所以n(Fe3+)基本不变,硫化氢不断被氧化成硫单质,
①由图中信息可知,0~t1时,铁离子浓度在下降,所以一定发生的反应是H2S+2Fe3+=2Fe2++S↓+2H+,
故答案为:H2S+2Fe3+=2Fe2++S↓+2H+;
②t1以后,溶液中n(Fe3+)保持基本不变,原因是t1时刻后,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,所以n(Fe3+)基本不变(或2H2S+O2=2S+2H2O),
故答案为:t1时刻后,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,所以n(Fe3+)基本不变(或2H2S+O2=2S+2H2O).
点评 本题考查学生对工艺流程的理解、阅读题目获取信息能力,有一定的综合性,难度不大,需要学生具备扎实的基础知识并能灵活运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始c(H+) | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 1.0×10-4 | 60 | 10 | 30 |
| ② | 1.0×10-5 | 60 | 10 | 30 |
| ③ | 1.0×10-5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比试验. | 反应进行相同时间后,若溶液中的Cr2O72-浓度大于实验①中Cr2O72-浓度,则假设一成立;若两溶液中的Cr2O72-浓度相同,则假设一不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
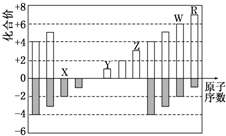
| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物的碱性:Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为12 | B. | 核电荷数为12 | ||
| C. | 电子数为28 | D. | 中子数与质子数之差为16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
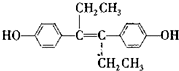 )是一种激素类药物,下列说法正确的是( )
)是一种激素类药物,下列说法正确的是( )| A. | R是芳香烃 | B. | R含2种含氧官能团 | ||
| C. | 1 mol R最多与1 mol H2加成 | D. | R能发生加成、取代和氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com