
【题目】氯碱工业中电解饱和食盐水的原理示意图如图所示: 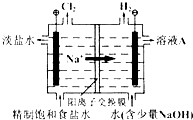
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
(4)电解所用的盐水需精制.去除有影响的Ca2+、Mg2+、NH4+、SO42﹣[c(SO42﹣>c(Ca2+)].精致流程如下(淡盐水和溶液A来自电解池): 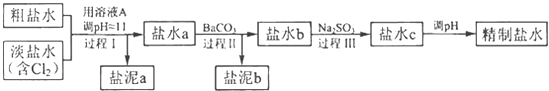
①盐泥a除泥沙外,还含有的物质是 .
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有 .
【答案】
(1)NaOH
(2)2Cl﹣+2H2O ![]() ?H2↑+Cl2↑+2OH﹣
?H2↑+Cl2↑+2OH﹣
(3)Cl2与水的反应为Cl2+H2O ![]() ?HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
?HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
(4)Mg(OH)2;2NH4++3Cl2+8OH﹣═N2↑+6Cl﹣+8H2O;SO42﹣、Ca2+
【解析】解:(1)电解饱和食盐水时,阴极反应式为:2H2O﹣2e﹣═2OH﹣+H2↑,阳极反应式为:2Cl﹣﹣2e﹣═Cl2↑,阴极产物为NaOH和H2 , 阳极产物是Cl2 , 据此可以确定溶液A的溶质是NaOH,所以答案是:NaOH;(2)根据阳极极和阴极的反应式可得电解反应的离子方程式是2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣ , 所以答案是:2Cl﹣+2H2O
H2↑+Cl2↑+2OH﹣ , 所以答案是:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣;(3)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O
H2↑+Cl2↑+2OH﹣;(3)电解时用盐酸控制阳极区溶液的pH在2~3的作用是促使化学平衡Cl2+H2O ![]() HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
HCl+HClO向左移动,减少Cl2在水中的溶解,有利于Cl2的逸出,
所以答案是:Cl2与水的反应为Cl2+H2O ![]() HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;(4)①根据粗盐水和淡盐水的化学成分,代入题给精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2 ,
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出;(4)①根据粗盐水和淡盐水的化学成分,代入题给精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2 ,
所以答案是:Mg(OH)2;②将NH4+转化为N2的氧化剂是Cl2 , 对应的离子方程式是2NH4++3Cl2+8OH﹣═N2↑+6Cl﹣+8H2O,
所以答案是:2NH4++3Cl2+8OH﹣═N2↑+6Cl﹣+8H2O;③过程II是利用沉淀溶解平衡原理,将溶液中的Ca2+和SO42﹣分别转化为CaCO3和BaSO4沉淀除去,
所以答案是:SO42﹣、Ca2+;


科目:高中化学 来源: 题型:
【题目】将下图所示实验装置的 K 闭合,下列判断正确的是

A. Cu电极上发生还原反应 B. 电子沿 Zn→a→b→Cu路径流动
C. 片刻后甲池中c(SO![]() )增大 D. 片刻后可观察到滤纸b点变红色
)增大 D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)上述状态下可导电的是;
属于电解质的是;
属于非电解质的是 .
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑨在水中的电离方程式为 , 34.2g ⑨溶于水配成250mL溶液,SO42﹣的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解化学方程式或水解离子方程式正确的是: ( )
A. CH3COO— + H2O![]() CH3COOH + OH— B. NH4+ + H2O=NH4OH + H+
CH3COOH + OH— B. NH4+ + H2O=NH4OH + H+
C. CH3COOH + NaOH![]() CH3COONa + H2O D. NaCl + H2O
CH3COONa + H2O D. NaCl + H2O![]() NaOH + HCl
NaOH + HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是
A. AgCl的悬浊液中通入少量HCl,c(Ag+)减小
B. AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360
C. AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成
D. 等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述与示意图形不一致的是

A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液pH随加酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量0.1 mol·L-1草酸溶液混合,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g) →CH3CH3(g);ΔH>0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中最终有白色沉淀生成的是
①向饱和碳酸钠溶液中通入CO2至过量 ②向Ba(NO3)2溶液中通入SO2至过量
③向BaCl2溶液中通入CO2至过量 ④向澄清石灰水中逐渐通入CO2至过量
A. ①④ B. ①② C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com