
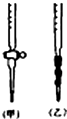
 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题:分析 (1)①根据中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作;
②氢氧化钠与H2SO4恰好中和溶液的pH为7,可选择酸性或碱性变色范围内的指示剂;
③根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小;
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是100mL容量瓶;
(4)根据溶液浓度越稀,误差就越小选择;
(5)碱性溶液盛放在碱式滴定管中;
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小;
(7)先根据滴定消耗的氢氧化钠溶液的体积及反应方程式计算出待测液硫酸的物质的量浓度,再根据稀释前后溶质的物质的量不变来计算.
解答 解:(1)①中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,所以滴定操作的正确顺序是ECDBAGF;
故答案为:ECDBAGF;
②氢氧化钠与H2SO4恰好中和溶液的pH为7,可选择酸性变色范围内的指示剂甲基橙,也可选择碱性变色范围内的指示剂酚酞;
故答案为:甲基橙或酚酞;
③用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色,则到达滴定终点;用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色,则到达滴定终点;
故答案为:用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色或用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小,滴定时消耗的氢氧化钠的体积偏大,所以计算结果偏大;
故答案为:偏大;
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是100mL容量瓶;故答案为:100mL容量瓶;
(4)因为溶液浓度越稀,误差就越小,所以应用0.1 mol•L-1的NaOH溶液;故答案为:0.1 mol•L-1;溶液浓度越稀,误差就越小
(5)碱性溶液盛放在碱式滴定管中,所以标准NaOH溶液注入碱式滴定管中,即乙图;故答案为:乙;
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小,所以测定的硫酸的浓度偏小;故答案为:偏小;
(7)根据反应:2NaOH+H2SO4=Na2SO4+2H2O,稀释后的硫酸溶液浓度c(H2SO4)=$\frac{\frac{1}{2}×0.14×15×10{\;}^{-3}}{25×10{\;}^{-3}}$mol/L=0.042mol/L,待测硫酸(稀释前的硫酸)溶液的物质的量浓度c(H2SO4)=$\frac{0.042mol/L×100mL}{1.00mL}$=4.20mol/L,
故答案为:4.20mol/L.
点评 本题考查了酸碱中和滴定,题目难度中等,涉及了实验步骤、滴定方法、误差分析、浓度计算等知识,注意掌握误差分析的方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 9 | C. | 12 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.
某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.| 序号 | 选用指示剂 | 选用滴定管 |
| A | 石蕊 | (乙) |
| B | 甲基橙 | (甲) |
| C | 酚酞 | (甲) |
| D | 酚酞 | (乙) |
| 试验编号 | 待测盐酸溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) |
| ① | 25.00 | 0.00 | 20.00 |
| ② | 25.00 | 1.10 | 21.30 |
| ③ | 25.00 | 0.20 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出| 锥形瓶中的液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| ① | 碱 | 酸 | 石蕊 | (乙) |
| ② | 酸 | 碱 | 酚酞 | (甲) |
| ③ | 碱 | 酸 | 酚酞 | (甲) |
| ④ | 酸 | 碱 | 酚酞 | (乙) |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的氯水加入到盛有NaBr溶液的试管中 | |
| B. | 取一小片铝,砂纸除去氧化膜,放入试管中,加入少量2mL水 | |
| C. | 将锌片与铜片用导线连接,插入盛稀硫酸的烧杯中 | |
| D. | 向盛有过氧化氢水溶液的试管中,加入少量1mol/LFeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | X>Z>Y | C. | Y>X>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com