
����Ŀ����֪��Ӧ: 2SO3(g) ![]() 2SO2(g)+O2(g) ��H>0��ij�¶� �£���2molSO3����10L�ܱ������У���Ӧ��ƽ���SO3��ƽ��ת����(a)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����
2SO2(g)+O2(g) ��H>0��ij�¶� �£���2molSO3����10L�ܱ������У���Ӧ��ƽ���SO3��ƽ��ת����(a)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����

����ͼ���ƶϣ�B��SO2��ƽ��Ũ��Ϊ03mol/L
����ͼ���ƶϣ�A���Ӧ�¶��µ�ƽ�ⳣ��Ϊ1.25��10-3
�۴�ƽ���ѹ�������ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ
����ͬѹǿ����ͬ�¶���SO3��ת�������¶ȹ�ϵ���ͼ��ʾ
A. �٢� B. �ڢ� C. �ۢ� D. �٢�
���𰸡�B
������������������ʼŨ��Ϊ![]() =0.2mol/L���ɼ�ͼ��֪B��SO3��ת����Ϊ0.15������Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ����ԡ�c��SO2��=��c��SO3��=0.15��0.2mol/L=0.03mol/L���ʶ��������ƽ��Ũ��Ϊ0.03mol/L���ٴ���A��ʱ��SO3��ת����Ϊ0.20����c��SO3��=0.20��0.2mol/L=0.04mol/L��ƽ��ʱ��SO3��SO2��O2��Ũ�ȷֱ�Ϊ0.16 mol/L��0.04mol/L��0.02mol/L��K=
=0.2mol/L���ɼ�ͼ��֪B��SO3��ת����Ϊ0.15������Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ����ԡ�c��SO2��=��c��SO3��=0.15��0.2mol/L=0.03mol/L���ʶ��������ƽ��Ũ��Ϊ0.03mol/L���ٴ���A��ʱ��SO3��ת����Ϊ0.20����c��SO3��=0.20��0.2mol/L=0.04mol/L��ƽ��ʱ��SO3��SO2��O2��Ũ�ȷֱ�Ϊ0.16 mol/L��0.04mol/L��0.02mol/L��K=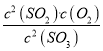 =1.25��10-3������ȷ����˷�ӦΪ�����巴Ӧ��ѹ��������൱������ѹǿ��ƽ�������������С�ķ����ƶ����������ƶ����������С�������ʵ�Ũ�����ʻ�ѧ��Ӧ���ʼӿ죬����ȷ�������¶�ƽ�������ȵķ����ƶ����������ƶ���SO3��ת���ʽ�������ͼ�� (ͼ���ϸ����ȹ���ƽ��ԭ��T1����T2�������¶ȣ�SO3��ת���ʼ�С) �����ϣ��ܴ���������������ѡ��B��
=1.25��10-3������ȷ����˷�ӦΪ�����巴Ӧ��ѹ��������൱������ѹǿ��ƽ�������������С�ķ����ƶ����������ƶ����������С�������ʵ�Ũ�����ʻ�ѧ��Ӧ���ʼӿ죬����ȷ�������¶�ƽ�������ȵķ����ƶ����������ƶ���SO3��ת���ʽ�������ͼ�� (ͼ���ϸ����ȹ���ƽ��ԭ��T1����T2�������¶ȣ�SO3��ת���ʼ�С) �����ϣ��ܴ���������������ѡ��B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˷�Ӧ�����ܷ���Ҳ������Ԫ�ء�2016 ���������ȷ�ϣ�����ԭ�Ӻ˼��ײ���������ԭ�������ֱ�Ϊ113��115��117 ��118 ������Ԫ�أ����ĿǰԪ�����ڱ��Ŀհף�����113 ��Ԫ����Al Ԫ�ش���ͬһ���塣����˵����ȷ����
A.�˷�Ӧ����ʵ���˻�ѧ�ܵ����ܵ�ת��
B.115 ��Ԫ��һ���Ǵ���VA ��ķǽ���Ԫ��
C.117 ��Ԫ����F��Cl��Br��I������VIIA��
D.������Ԫ��λ��Ԫ�����ڱ��еIJ�ͬ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�̸ɵ���ڷŵ�ʱ����ܷ�Ӧ����ʽΪZn��2MnO2��2NH![]() ===Zn2����Mn2O3��2NH3����H2O���ڴ˵�طŵ�ʱ������(̼��)�Ϸ�����Ӧ��������(����)
===Zn2����Mn2O3��2NH3����H2O���ڴ˵�طŵ�ʱ������(̼��)�Ϸ�����Ӧ��������(����)
A. п B. MnO2��NH![]() C. ̼ D. Zn2����NH3
C. ̼ D. Zn2����NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ľṹ������ʽ�������ģ����ͼ1�����л����ӵĺ˴Ź�������ͼ��ͼ2����λ��ppm�������й��ڸ��л����������ȷ���ǣ������� 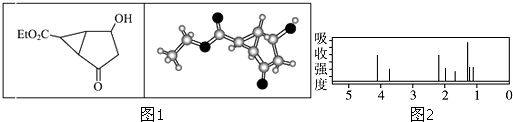
A.���л��ﲻͬ��ѧ��������ԭ����6��
B.���л������ڷ��㻯����
C.����ʽ�е�Et�����Ļ���Ϊ��CH3
D.���л�����һ���������ܹ�������ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��пƬ��ͭƬ��ϡ����������ɵ�ԭ���װ�ã�c��dΪ�����缫�������йص��жϲ���ȷ����

A. ��ع����Ĺ����У�d�缫�ϲ�������
B. ��ع���ʱ����Һ��SO42����d�ƶ�
C. cΪ����������������Ӧ
D. ��ع����Ĺ����У���Һ��SO42��Ũ�Ȼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ҫԭ�����ŷ�SO2�йص��ǣ� ��
A.����ЧӦ
B.�⻯ѧ����
C.�����ն�
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�ؼס��ҡ����������졢�����������ڱ��е����λ����ͼ���ײ�һ���ڶ������������ϣ����졢���ֱ��ǿ������ؿ��к�������Ԫ�ء������ж���ȷ����

A. ��һ���ǽ���Ԫ��
B. ��̬�⻯����ȶ��ԣ���>��>��
C. �ҡ������������������ˮ������������Ӧ
D. �������������ˮ����������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȡ�������Ļ���������������������������е���ϵ����ش��������⣺
��1����仯ѧ�����ս����̿���Ҫ�ɷ���MnO2����Ũ�����ϼ��ȣ��������������Ƶ�����������Ӧ�Ļ�ѧ����ʽΪ��_________________________�����У���������_______����ʵ�����Ƶñ�״����4.48L��������ת�Ƶ��ӵ���ĿΪ_____����
��2���ڵ��Ļ������У�����ɫ���д̼�����ζ���ж�������___________����д��ѧʽ������д����������ˮ��Ӧ�Ļ�ѧ����ʽ________________________��
��3������ƽŨ�����ڼ���ʱ��̼������Ӧ�Ļ�ѧ����ʽ��____C+____H2SO4(Ũ)=__CO2��+_____SO2��+____H2O��
�ڸ÷�Ӧ�У�ŨH2SO4���ֳ�___________(���ˮ��������ˮ����������)�ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���������壨NiC2O42H2O��������ˮ����ҵ�ϴӷ�����������Ҫ�ɷ���Ni������һ������Al2O3��Fe��SiO2��CaO�ȣ��Ʊ������������������ͼ��ʾ��
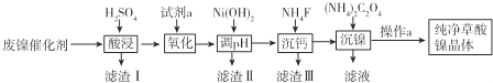
��֪������ؽ������������������������pH�����
�������� | Fe3+ | Fe2+ | Al3+ | Ni2+ |
��ʼ������pH | 1.1 | 5.8 | 3.0 | 6.8 |
��ȫ������pH | 3.2 | 8.8 | 5.0 | 9.5 |
��Ksp(CaF2)=1.46��10-10
����ij����Ũ��С��1.0��10-5mol��L-1ʱ����Ϊ��ȫ������
��ش��������⣺
��1����д��һ�����������������ʵĴ�ʩ��______________________________________��
��2���Լ�a��һ����ɫ��������д������ʱ��Ӧ�����ӷ���ʽ��__________________________________��
��3������pH�ķ�ΧΪ________�����û�ѧ��Ӧԭ�������֪ʶ���������������ɣ�_____________��
��4��д������ʱ��Ӧ�����ӷ���ʽ��________________________________________________��֤��Ni2+�Ѿ�������ȫ��ʵ�鲽�輰������_____________________________________����Ca2+������ȫʱ����Һ��c��F-��>________mol��L-1��
��5������a��������_____________________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com