
| A. | Ca2+1s22s22p63s23p6 | B. | O2-1s22s22p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar1s22s22p63s23p6 |
分析 原子或离子的电子排布应符合能量最低原理,一般来说离子的核外最外层达到8电子稳定结构,根据构造原理,s能级最多可容纳2个电子,p能级有3个轨道最多可容纳6个电子,电子总是优先从能量低的能层、能级排列,其中s2是原子得两个电子形成的稳定的结构,所以第三能层中的电子排布应为3s23p6,以此判断.
解答 解:A.Ca的原子序数为20,离子的核外电子排布式为1s22s22p63s23p6,最外层达到8电子稳定结构,故A正确;
B.O的原子序数为8,离子的核外电子排布式为1s22s22p6,最外层应达到8电子稳定结构,故B错误;
C.Cl的原子序数为17,离子的核外电子排布式为1s22s22p63s23p6,最外层应达到8电子稳定结构,故C正确;
D.Ar的核外有18个电子,核外电子排布式为1s22s22p63s23p6,符合能量最低原理,故D正确.
故选B.
点评 本题考查的是构造原理及各能级最多容纳的电子数,题目难度不大,注意把握原子核外电子排布规律.


科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| B. | 氨水中通入过量SO2:NH3•H2O+SO2═HSO3-+NH4+ | |
| C. | 饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol•L-1,则H2的反应速率为0.03 mol•(L•min-1) | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液中恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度和减小压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 两种有机物的结构简式
两种有机物的结构简式 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
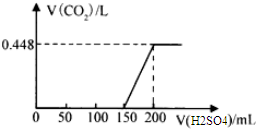
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
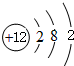 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com