
| A. | 1.4 g乙烯与丙烯的混合气体含有NA个碳原子 | |
| B. | 精炼铜,若阳极失去2NA个电子,则阴极增重64 g | |
| C. | 在1 L 0.1mol/L 的Na2CO3溶液中,阴离子总数小于0.1NA | |
| D. | 将1 L 2 mol/L 的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA |
分析 A、乙烯和丙烯的最简式均为CH2;
B、精炼铜时,阳极和阴极上得失电子数相等;
C、碳酸根的水解导致阴离子个数增多;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、乙烯和丙烯的最简式均为CH2,故1.4g混合物中含有的CH2的物质的量为n=$\frac{1.4g}{14g/mol}$=0.1mol,故含0.NA个碳原子,故A错误;
B、精炼铜时,阳极上失去2mol电子时,则阴极上得到2mol电子,而阴极上是铜离子放电,故生成1mol铜,质量为64g,故B正确;
C、碳酸根的水解导致阴离子个数增多,故在1 L 0.1mol/L 的Na2CO3溶液中,阴离子个数大于0.1NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故所得氢氧化铁胶粒的个数小于2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:
已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是复分解反应 | |
| B. | 该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl | |
| C. | 反应中Cl2既是氧化剂,又是还原剂 | |
| D. | 生成2 mol ClO2时转移的电子数为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
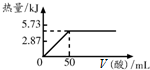 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如下图所示(不考虑热量的散失),则该酸可能是( )
已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如下图所示(不考虑热量的散失),则该酸可能是( )| A. | 醋酸(CH3COOH) | B. | 盐酸 | C. | 草酸(HOOC-COOH) | D. | 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
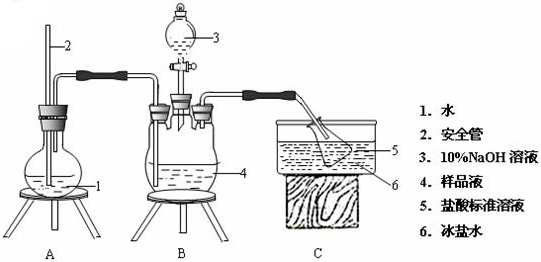
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25.4ρ | B. | 12.7ρ | C. | 6.97ρ | D. | 6.35ρ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 降低温度 | C. | 减小压强 | D. | 加入O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com