
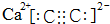 .
.分析 (1)①电石主要成分碳化钙,碳化钙为离子化合物,根据离子化合物电子式的书写方法来分析;
②CaC2与水反应生成Ca(OH)2和C2H2;
③硫化钙与水反应生成硫化氢,硫化氢能与高锰酸钾溶液、氢氧化钠溶液反应,乙炔也能被高锰酸钾反应;
(2)①根据元素守恒确定X中元素,根据转移电子守恒、原子守恒确定X化学式;
②根据题意可知,碱性条件下CN-与NaClO反应生成N2、CO32-和Cl-,根据氧化还原反应配平;n(N2)=$\frac{0.168L}{22.4L/mol}$=0.0075mol,根据方程式计算消耗的CN-,再计算CN-的处理率;
③浓度均为0.1mol/L的NaCN和HCN的混合液显碱性,则NaCN的水解程度大于HCN的电离程度.
解答 解:(1)①电石主要成分碳化钙,碳化钙为离子化合物,其电子式为: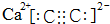 ;
;
故答案为: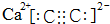 ;
;
②CaC2与水反应生成Ca(OH)2和C2H2,其反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑;
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
③电石中的杂质硫化钙也会与水反应,硫化钙与水反应生成硫化氢,硫化氢能与高锰酸钾溶液、氢氧化钠溶液反应,乙炔也能被高锰酸钾反应,所以应该用NaOH溶液吸收硫化氢;
故答案为:D;
(2)①根据元素守恒知,X中含有Na、C元素,该反应中N元素化合价由-3价转化为0价、NaCN中C元素化合价为+2价,则C元素化合价由+2价转化为+4价,转移电子数为6,根据转移电子守恒、原子守恒知X为NaHCO3,
故答案为:NaHCO3;
②由题意可知,碱性条件下CN-与NaClO反应生成N2、CO32-和Cl-,反应离子方程式为2CN-+5ClO-+2OH-=2CO32-+N2↑+5Cl-+H2O;n(N2)=$\frac{0.168L}{22.4L/mol}$=0.0075mol,由方程式可知,消耗CN-的物质的量为n(CN-)=0.015mol,则CN-的处理率为$\frac{0.015mol}{0.4mol/L×0.05}$×100%=75%;
故答案为:2CN-+5ClO-+2OH-=2CO32-+N2↑+5Cl-+H2O;75%;
③浓度均为0.1mol/L的NaCN和HCN的混合液显碱性,则NaCN的水解程度大于HCN的电离程度,则浓度关系为c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+);
故答案为:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+).
点评 本题考查了氧化还原反应方程式的配平、电子式、元素化合物的性质、离子浓度大小比较等,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
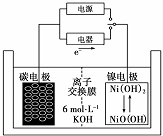
| A. | 充电时阴极发生氧化反应 | |
| B. | 充电时将碳电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e -=2H+ | |
| D. | 放电时镍电极反应为NiO(OH)+H20+e-=Ni( OH)2+OH - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、Al3+、Cl?能大量共存 | |
| B. | 溶液中c(H2CO3)<c(CO32?) | |
| C. | 该溶液中阳离子总数大于阴离子总数 | |
| D. | 常温下,加水稀释,$\frac{c({H}^{+}).c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
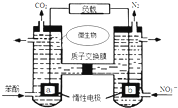
| A. | a电极发生还原反应,做原电池的正极 | |
| B. | b电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 标准状况下,电路中产生6moLCO2同时产生22.4L的N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42g丙烯和环丙烷的混合气体中所含极性键的数目为9NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的数目为0.5NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离出的OH-的数目为0.1NA | |
| D. | 3.6 g CaO2晶体中阴离子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液:Al3+、Cu2+、I-、S2O32- | |
| B. | 常温下加水稀释时c(H+)/c(OH-)明显增大的溶液:CH3COO-、Ba2+、NO3-、Br- | |
| C. | 0.1mol/LFe(NO3)2溶液:S2-、Na+、SO42-、Cl- | |
| D. | 0.1mol/LNaAlO2溶液:NH4+、K+、HCO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | Y、Z、B、W、A元素性质均较为活泼,但其中的某些元素在自然界中仍可以游离态的形式存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阴离子交换膜 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | cB=$\frac{ν_B}{ν_A}$•$\frac{{{c_A}{V_A}}}{V_B}$ | B. | cB=$\frac{ν_B}{ν_A}$•$\frac{{{c_A}{V_B}}}{V_A}$ | ||
| C. | cB=$\frac{{{c_A}{V_A}}}{V_B}$ | D. | cB=$\frac{ν_A}{ν_B}$•$\frac{{{c_A}{V_A}}}{V_B}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com