
(1)1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是____________。
A.Na+(g)+Cl-(g)―→NaCl(s);△Q
B.Na(s)+Cl2(g)―→NaCl(s);△Q1
C.Na(s)―→Na(g);△Q2
D.Na(g)-e-―→Na+(g);△Q3
E.Cl2(g)―→Cl(g);△Q4
F.Cl(g)+e-―→Cl-(g);△Q5
②写出△Q1与△Q、△Q2、△Q3、△Q4、△Q5之间的关系式________________________________________________________________________
(2)可逆反应:aA(g)+bB(g) ![]() ??cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2 min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表示这段时间内反应的平均速率应为__________ __。
??cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2 min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表示这段时间内反应的平均速率应为__________ __。
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:阅读理解
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 520 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年度陕西省宝鸡中学上学期高二期末考试化学试卷 题型:填空题
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子( 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2012届安徽合肥八中高三第四次月考化学试卷 题型:计算题
(4分 )(1)化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH=" 436" kJ·mol-1],形成 化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH =" -185" kJ·mol-1
ΔH298(H2)=" 436" kJ·mol-1 ,ΔH298(Cl2)=" 247" kJ·mol-1
则ΔH298(HCl)=" ________________________" 。
(2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH =" -25" kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH =" -" 47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH =" 19" kJ·mol-1
请写出CO还原FeO的热化学方程式:________________________________________
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽合肥八中高三第四次月考化学试卷 题型:计算题
(4分 )(1)化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH= 436 kJ·mol-1],形成化学键时ΔH<0[如2H(g)=H2(g) ΔH = - 436 kJ·mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH = -185 kJ·mol-1
ΔH298(H2)= 436 kJ·mol-1 ,ΔH298(Cl2)= 247 kJ·mol-1
则ΔH298(HCl)= ________________________ 。
(2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH = -25 kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH = - 47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH = 19 kJ·mol-1
请写出CO还原FeO的热化学方程式:________________________________________
查看答案和解析>>
科目:高中化学 来源:2013届度陕西省上学期高二期末考试化学试卷 题型:填空题
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子(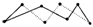 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com