
| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |
分析 酸式盐NaHY的水溶液的pH=6,溶液呈酸性,说明HY-的电离程度大于水解程度,HY-电离程度较强:HY-?Y2-+H+,HY-水解程度较弱:HY-+H2O?H2Y+OH-,
考虑水还要电离出H+,则c(H+)>c(Y2-)>c(OH-)、c(H2Y)<c(Y2-)<<c(HY-),c(HY-)较大是因为电离和水解是都是较弱的,溶液中剩余的HY-仍较多,
A.根据题意Na2Y是强碱弱酸盐,水解呈碱性,NaHY溶液是电离程度大于水解程度,呈酸性;
B.HY-电离程度较强,则c(H+)>c(Y2-)>c(OH-)、c(H2Y)<c(Y2-)<<c(HY-);
C.HY-水解生成氢氧根离子和H2Y;
D.Na2Y、NaHY、H2Y的溶液中存在的阴离子为:OH-、Y2-、HY-.
解答 解:酸式盐NaHY的水溶液的pH=6,溶液呈酸性,说明HY-的电离程度大于水解程度,HY-电离程度较强:HY-?Y2-+H+,HY-水解程度较弱:HY-+H2O?H2Y+OH-,
考虑水还要电离出H+,则c(H+)>c(Y2-)>c(OH-)、c(H2Y)<c(Y2-)<<c(HY-),c(HY-)较大是因为电离和水解是都是较弱的,溶液中剩余的HY-仍较多,A.根据题意Na2Y是强碱弱酸盐,水解呈碱性,NaHY溶液是电离程度大于水解程度,呈酸性,所以Na2Y溶液的pH大于aHA溶液,故A正确;
B.HY-电离程度较强,则c(H+)>c(Y2-)>c(OH-)、c(H2Y)<c(Y2-)<<c(HY-);溶液中正确的离子浓度大小为:(Na+)>c(HY-)>c(H+)>c(Y2-)>c(OH-),故B错误;
C.HY-的水解生成氢氧根离子和H2Y,其正确的水解方程式为:HY-+H2O?H2Y+OH-,故C错误;
D.在Na2Y、NaHY、H2Y的溶液中存在的阴离子为:OH-、Y2-、HY-,含有的阴离子种类相同,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解为解答关键,注意掌握盐的水解与弱电解质的电离方程式的区别,试题培养了学生的分析能力及灵活运用能力.


科目:高中化学 来源: 题型:解答题
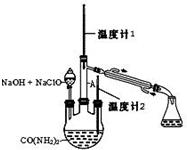 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl>NaCl>BaO>CaO | B. | NaCl>KCl>CaO>BaO | ||
| C. | CaO>BaO>KCl>NaCl | D. | CaO>BaO>NaCl>KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共七个横行代表七个周期,18个纵行代表18个族 | |
| D. | 主族元素原子的最外层电子数等于该元素所属的族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A):N(C)=2:1 | N(A):N(C)=1:1 | N(B):N(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D):N(C)=1:1 | N(E):N(F)=1:3 | N(B):N(F)=1:4 |
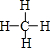 .
.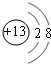 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com