
分析 分析反应中各元素化合价变化,依据氧化还原反应得失电子守恒规律结合原子个数守恒规律书写方程式计算电子转移数目;氧化还原反应中所含元素化合价升高的反应物为还原剂;根据氧化剂的氧化性大于氧化产物的氧化性;还原剂的还原性大于还原产物的还原性判断氧化性、还原性强弱情形.
解答 解:反应中氯气中Cl:0→-1,降1价,一个氯气分子中有2个Cl原子降2价,I2中I元素:0→+5,升5价,一个I2升10价,根据化合价升降相等,I2前配2,Cl2前配5,根据Cl元素守恒HCl前配10,根据I元素守恒HIO3前配2,根据H元素守恒H2O前配6,所以方程式为I2+5Cl2+6H2O=2HIO3+10HCl,反应中碘单质化合价升高,为还原剂,产物中HCl化合价降低所以为还原产物,Cl2中Cl元素化合价降低所以是氧化剂,HIO3中I元素化合价升高所以是氧化产物,根据还原剂的还原性大于还原产物的还原性可知Cl2的氧化性大于HIO3,I2还原性大于HCl,电子转移的方向和数目: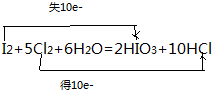 ,
,
故答案为: ;I2;HCl;Cl2;HIO3;I2;HCl.
;I2;HCl;Cl2;HIO3;I2;HCl.
点评 本题考查氯气的性质以及氧化性的强弱比较,明确氧化还原反应规律是解题关键,学会运用化合价升降相等进行氧化还原反应的配平,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
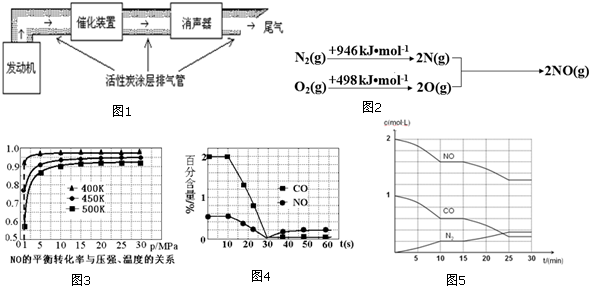
| A. | 合成氨反应是放热反应 | |
| B. | 合成氨反应是熵减小的反应 | |
| C. | 合成氨反应在任何条件下都可自发进行 | |
| D. | 降低温度、增大压强都有利于平衡向生成氨的方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2S液中:c(OH-)-c(HS-)-c(H+)=2c(H2S) | |
| B. | 0.2mol/L的NH3•H2O溶液和0.1mol/LHCl溶液等体积混合(pH>7):c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| C. | 0.1mol/L pH=7.8的NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 0.1mol/L Na2SO3溶液与0.1mol/L NaHSO3溶液等体积混合:2c(Na+)-3c(SO32-)=3c(HSO3-)+3c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
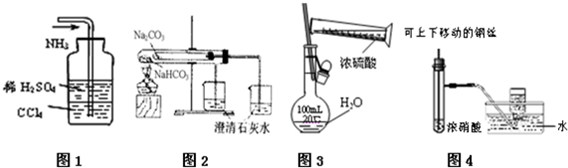
| A. | 图1吸收多余的NH3 | |
| B. | 图2为比较NaHCO3、Na2CO3相对热稳定性 | |
| C. | 图3为配制一定物质的量浓度的硫酸溶液 | |
| D. | 图4为制备并收集少量NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl2是平面对称型分子 | B. | 分子中C-H,C-Cl键长相等 | ||
| C. | CH2Cl2是非极性分子 | D. | CH4分子中C-H间键角是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com