
分析 (1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol,
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol,
依据盖斯定律$\frac{①+②}{2}$得到;
(2)化学平衡移动的因素:温度、浓度、压强等,使平衡向正反应方向移动;
(3)二氧化氮具有氧化性,亚硫酸钠具有还原性,根据氧化还原反应的规律知识书写反应方程式,通过化学反应方程式计算.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol,
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol,
依据盖斯定律$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)反应:2NH3(g)+NO(g)+NO2(g) $\stackrel{催化剂}{?}$ 2N2(g)+3H2O(g)△H<0,提高氮氧化物的转化率,可以使得化学平衡正向移动即可,可以增大NH3的浓度、减小反应体系的压强、降低反应体系的温度等,
故答案为:增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等;
(3)二氧化氮具有氧化性,亚硫酸钠具有还原性,二者之间会发生氧化还原反应:2NO2+4Na2SO3═N2+4Na2SO4,结合化学反应2NO+ClO2+H2O=NO2+HNO3+HCl知道,N2~2NO2~2ClO2,所以若生成11.2L即0.5molN2(标准状况),则消耗1molClO2质量是1mol×67.5g/mol=67.5g,
故答案为:2NO2+4Na2SO3═N2+4Na2SO4;67.5g.
点评 本题考查了热化学方程式的书写、影响化学平衡的因素、氧化还原反应的相关计算,侧重考查学生对数据的分析处理,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L戊烷中存在的共价键总数为1.6NA | |
| B. | 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1L0.1mol•L-1的NaH2PO4溶液中H2PO4-、HPO42-和PO43-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
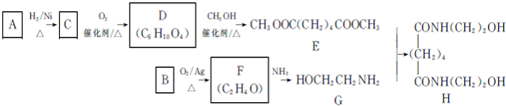
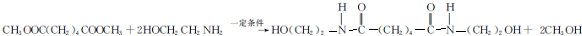 .
.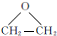 ,能发生银镜反应的F的同分异构体是CH3CHO.
,能发生银镜反应的F的同分异构体是CH3CHO.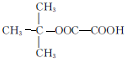 (写结构简式).
(写结构简式).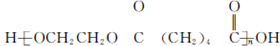 的合成路线:
的合成路线: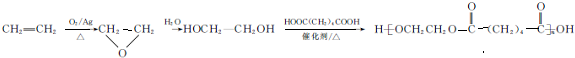 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、Mg、Li | B. | Li、C、Mg | C. | C、Si、Mg | D. | C、O、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 实验目的 |
| A | 在热的NaOH溶液中滴入饱和FeCl3溶液 | 制备Fe(OH)3胶体 |
| B | 将SO2通入KMnO4溶液 | 验证SO2的漂白性 |
| C | 向含少量Fe3+的MgCl2溶液中加入适量MgCO3粉末,加热、搅拌并过滤 | 除去MgCl2溶液中少量的Fe3+ |
| D | 将0.1mol•L-1的Na2SO4溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1的Na2CO3溶液 | 比较BaCO3与BaSO4溶度积的大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最易失去的电子能量最高 | |
| B. | 电离能最小的电子能量最高 | |
| C. | 2p轨道电子能量高于2s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com