
在恒温、体积为2 L的密闭容器中进行反应:2A(g)3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为( )
A.v(B)=0.03 mol·L-1·s-1
B.v(B)=0.045 mol·L-1·s-1
C.v(C)=0.03 mol·L-1·s-1
D.v(C)=0.06 mol·L-1·s-1
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
A.单质的化学活泼性:W<X<Y<Z
B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z
D.元素的最高化合价:W<X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
在以下过程中发生水解反应的是( )
A.棉织物滴浓硫酸变黑
B.皮肤上沾了浓硝酸后变黄
C.氨基酸之间反应,生成多肽
D.蛋白质在适当条件下生成氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
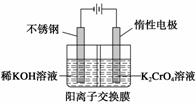
下列说法不正确的是( )
A.在阴极室,发生的电极反应为2H2O+2e-===2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO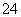 +2H+Cr2O
+2H+Cr2O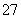 +H2O向右移动
+H2O向右移动
C.该制备过程中总反应的化学方程式为4K2CrO4+4H2O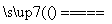 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1-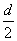
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加。

(1)写出乙中两极发生的电极反应式。
阴极:________________________________________________________________________;
阳极:________________________________________________________________________。
(2)写出甲中发生反应的化学方程式:___________________________________________。
(3)C(左)、C(右)、Fe、Ag 4个电极上析出或溶解物质的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g) ΔH<0
(1)当反应达到平衡时,N2和H2的浓度比是________;N2和H2的转化率比是________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量__________,密度__________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )
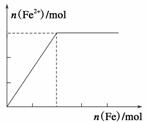
A.4∶1 B.3∶1 C.2∶1 D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质类别判断的依据正确的是( )
A.原子晶体:晶体的熔点是否很高
B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键
D.共价化合物:是否含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com