
| 滴定前 | 滴定后 | |
| 第一次 | 0.70 | 16.15 |
| 第二次 | 0.05 | 16.35 |
| 第三次 | 0.35 | 15.70 |
| V(标准)×c(标准) |
| V(待测) |
| 15.45+15.45 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1:1 |
| B、2:2:4 |
| C、1:2:2 |
| D、2:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物:盐酸、生铁、空气 |
| B、化合物:CaCl2、NaOH、HCl |
| C、碱:苛性钠、纯碱、氢氧化钾 |
| D、单质:Ca、O3、石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+184.6kJ?mol-1 |
| B、-92.3kJ?mol-1 |
| C、-369.2kJ?mol-1 |
| D、+92.3kJ?mol- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
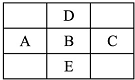 如图是周期表的一部分,A、B、C、D、E五种元素的原子核共含有80个质子.
如图是周期表的一部分,A、B、C、D、E五种元素的原子核共含有80个质子.查看答案和解析>>
科目:高中化学 来源: 题型:

| 电解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com