
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)A、C的化学式分别为A__________,C__________。
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是__________(填字母序号)。
A.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2―→F的化学方程式:__________________________________。
(4)若反应F+D―→E转移电子数为6.02×1023,则消耗D的质量为________。
科目:高中化学 来源: 题型:
联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“减碳”的手段之一是节能。下列制氢方法最节能的是________(填字母序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢: 2H2O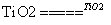 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O 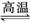 CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g) ΔH=-90.7 kJ·mol-1
CH3OH(g) ΔH=-90.7 kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为______________________。
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:
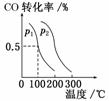 CO(g)+2H2(g)
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“=”),上述反应的ΔH________0(填“<”、“>”或“=”)。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“=”),上述反应的ΔH________0(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
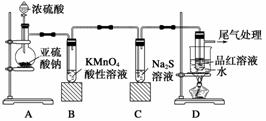
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为________________________________________________________________________。
(2)实验过程中,装置B、C中发生的现象分别是_______________________________
______________、_______________________________________________________;
这些现象分别说明SO2具有的性质是________________和________________;装置B中发生反应的离子方程式为___________________________________________________
________________________________________________________________________。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象________________________________________________________________________
________________________________________________________________________。
(4)尾气可采用________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
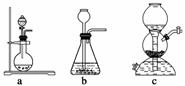
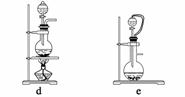
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36 L(标准状况)二氧化硫,至少需要称取亚硫酸钠________g(保留一位小数);如果已有40%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠________g (保留一位小数)。
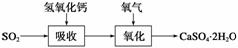
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰石膏法和碱法是常用的烟气脱硫法。
石灰石膏法的吸收反应为SO2+Ca(OH)2―→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O―→2CaSO4·2H2O。其流程如下图:
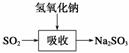
碱法的吸收反应为SO2+2NaOH―→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰石膏法和碱法吸收二氧化硫的化学原理相同之处是
________________________________________________________________________。
和碱法相比,石灰-石膏法的优点是_______________________________________,
缺点是__________________________________________________________________。
(4)在石灰石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式正确的是 ( )
A.在稀氨水中通入过量CO2:NH3·H2O+CO2===NH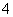 +HCO
+HCO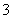
B.少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
D.向NH4HCO3溶液中加入足量Ba(OH)2溶液:2HCO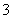 +Ba2++2OH-===BaCO3↓+CO
+Ba2++2OH-===BaCO3↓+CO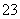 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
国际纯粹与应用化学联合会(IUPAC)将117号元素暂时命名为Uus,以下关于Uus的叙述正确的是
A.是稀有气体 B.有放射性 C.是第六周期元素 D.质量数为117
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象中,能用键能大小解释的是
A. 氮气的化学性质比氧气稳定 B. 常温常压下,溴呈液态,碘呈固态
C. 稀有气体一般很难发生化学反应 D. 硝酸易挥发,而硫酸难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO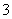 )=3 mol·L-1。
)=3 mol·L-1。
(1)求稀释后的溶液c(H+)=________mol/L
(2)若a=9,则生成的气体中NO2的物质的量为________mol。
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol·L-1的NaOH恰好被吸收,NaOH溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于铯(Cs)及其化合物的性质,说法正确的是( )
A.金属铯的熔点比金属钠高 B.CsOH比NaOH的碱性弱
C.Cs与H2O能剧烈反应,甚至发生爆炸 D.碳酸铯难溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com