
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下:
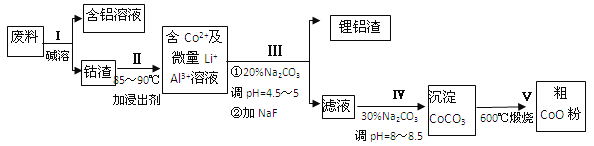
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为 (产物中只有一种酸根).请从反应原理分析不用盐酸浸出钴的主要原因 .
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用: .
【答案】
(1)2Al+2OH﹣+2H2O=+2AlO2﹣+3H2↑;
(2)4Co2O3CoO+S2O32﹣+22H+=12Co2++2SO42﹣+11H2O;Co2O3CoO;可氧化盐酸产生Cl2污染环境;
(3)2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑;Co2++CO32﹣=CoCO3↓;
【解析】
试题分析:制备氧化钴的大致流程为:制备流程为:废料用碱液溶解,过滤得到偏铝酸钠溶液和钴渣;用硫酸溶解钴渣,发生反应:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,得到含有钴离子的溶液,然后调节溶液pH并用碳酸钠溶液除去杂质铝离子,得到较纯净的含有钴离子的溶液,再加入碳酸钠、调节溶液的pH将钴离子转化成碳酸钴沉淀,最后灼烧碳酸钴得到氧化钴。
(1)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为:2Al+2OH-+2H2O=+2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,改写成离子方程式为:4Co2O3CoO+S2O3 2-+22H+=12Co2++2SO42-+11H2O,盐酸具有还原性,能被Co2O3CoO氧化生成有毒的氯气而污染环境,所以不用盐酸,故答案为:4Co2O3CoO+S2O3 2-+22H+=12Co2++2SO42-+11H2O;Co2O3CoO可氧化盐酸产生Cl2污染环境;
(3)碳酸钠溶液在过程Ⅲ中铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,反应的两种方式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;碳酸钠溶液在过程Ⅳ中调整pH,提供CO32-,使Co2+沉淀为CoCO3,反应的离子方程式为:Co2++CO32-=CoCO3↓,故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;Co2++CO32-=CoCO3↓。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】把aL含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用bmol烧碱刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗cmolBaCl2,则原溶液中c(NO3-)为( )
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m g镁铝合金投入到500 ml 2 mol/L的盐酸中,固体完全溶解,收集到气体5.6L (标准状况下)。向反应所得溶液中加入4mol/L的氢氧化钠溶液,沉淀达到最大值为13.60 g,则m的值为
A. 11.48 B. 9.35 C. 8.50 D. 5.10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中常见有机物的叙述正确的是
①多次咀嚼馒头有甜味,此过程中淀粉发生了水解反应
②肥皂的主要成分属于高级脂肪酸盐
③糖类物质均不能使溴水和酸性KMnO4溶液褪色
④天然蛋白质水解的最终产物均为a-氨基酸
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取Fe、FeO、Fe2O3的均匀混合物质量为7.2g,向其中加入200 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出1120 mL(标准状况)的气体。所得溶液中,加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此混合物,能产生铁的质量为 ( )
A. 1.4g B. 2.8g C. 5.6g D. 11.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是
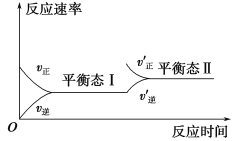
A.反应达到平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增加反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某种仪器量取液体体积,平视时读数为 n mL,仰视时读数为 x mL,俯视时读数为 y mL,若 x>n>y,则所用的仪器可能为
A. 量筒 B. 容量瓶 C. 滴定管 D. 以上均不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
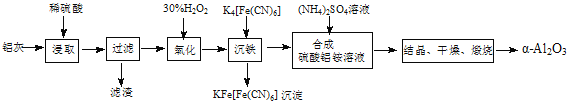
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
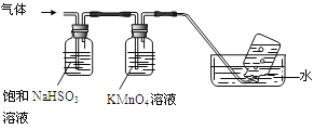
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com