
| A、1L 0.1 mol?L-1 NaCl溶液中含0.1NA个Na+ |
| B、22.4L NH3含4NA个原子 |
| C、标准状况下,22.4L H2O中含有10NA个电子 |
| D、NA个SO2分子的质量为64 g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、②④ | B、①③④ |
| C、①②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol |
| B、0.5mol |
| C、1mol |
| D、2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
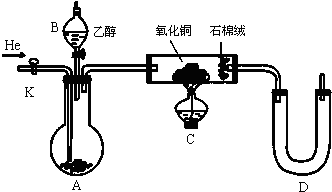
查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是(双选)( )
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是(双选)( )| A、A分子属于酯类化合物,在一定条件下能发生水解反应 |
| B、A在一定条件下可与4 mol H2发生加成反应 |
| C、符合题中A分子结构特征的有机物只有1种 |
| D、与A属于同类化合物的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 研碎后加入试剂1 |
| 静置 |
| KSCN溶液 |
| 新制氯水 |
| Vc |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com