
29.(18分)在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
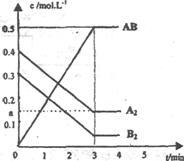 (1)该反应进行到__________min时达到平衡,用AB表示的平均反应速率为: mol/(L.min)(用分数表示)。
(1)该反应进行到__________min时达到平衡,用AB表示的平均反应速率为: mol/(L.min)(用分数表示)。
(2)图中对应的a的数值是_________,该反应的化学平衡常数Kc=__________(保留分数)。温度升高Kc值___________(填“增大”、“减少”或“不变”)。
(3)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线。
(4)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向 反应方向进行(填“正”或“逆”)。判断依据是 。反应达到平衡后,各物质的体积分数与原平衡相比___________(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“=”、“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)多少克锌与500ml 0.1mol/L硫酸恰好反应,在标准状况下能生成多少升氢气?
(2)计算溶质的质量分数为36.5%的浓盐酸(密度为1.19g/cm3)的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知450 ℃时,反应H2(g)+I2(g)  2HI(g)的K = 50,由此推测在450 ℃时,反应2HI(g)
2HI(g)的K = 50,由此推测在450 ℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A、50 B、0.02 C、100 D、无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
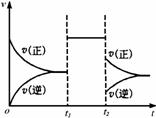
可逆反应aX+2Y(g)  2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如右图。则下列说法中正确的是
2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如右图。则下列说法中正确的是
A.若X是固体,则t1时一定是增大了容 器的压强
B.若X是气体,则t2时可能是增大了容器的压强
C.若X是固体,则t1时可能是增大了X的质量
D.t2时不可能是减小容器压强;若采用了降温措施,则该反应的正反应方向△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在密闭容器中发生反应2M(g)+N(g) 2E(g),若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了10%;若开始只充入2mol M和1mol N混合气体,达平衡时M的转化率为
2E(g),若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了10%;若开始只充入2mol M和1mol N混合气体,达平衡时M的转化率为
A.20% B.60% C.80% D.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g) △H<0
2C(g) △H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
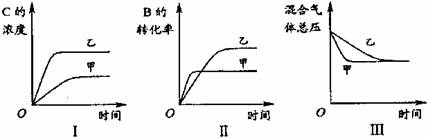
下列判断一定错误的是
①图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
②图Ⅱ研究的是压强对反应的影响,且甲的压强较高
③图Ⅱ研究的是温度对反应的影响,且甲的温度较高
④图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
⑴该温度下,水的离子积常数Kw= 。
⑵在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= 。
⑶该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
⑷该温度下,pH=3的硫酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7);pH=3的醋酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是 ( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl‾、S2‾、Ca2+、K+半径逐渐减小
D.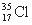 与
与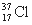 得电子能力相同
得电子能力相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com