
| A. | 室温下,21.0 g乙烯与丙烯的混合气体中含有的碳原子数为1.5 NA | |
| B. | 常温常压下,0.1molC8H18所含有的共价键数目为2.0 NA | |
| C. | 0.1mol乙醇与氧气完全反应生成二氧化碳时转移电子数为0.1NA | |
| D. | 标准状况下,2.24L乙酸乙酯中所含氧原子数为0.2NA |
分析 A.乙烯与丙烯最简式相同为CH2,计算21.0gCH2含有碳原子数;
B.C8H18是烷烃,依据烷烃结构分析计算共价键数;
C.根据C2H6O~3O2,O2$\stackrel{+4e-}{→}$2O2-计算;
D.标准状况下,乙酸乙酯不是气体.
解答 解:A.乙烯与丙烯最简式相同为CH2,计算21.0gCH2含有碳原子数=$\frac{21.0g}{14g/mol}$×1×NA=1.5NA,故A正确;
B.C8H18是烷烃,依据烷烃结构分析计算共价键数=0.1mol×(8-1+18)×NA=2.5NA,故B错误;
C.C2H6O~3O2,0.1mol乙醇消耗3molO2,又O2$\stackrel{+4e-}{→}$2O2-,0.3molO2得到1.2mol电子,因此转移电子数为1.2NA,故C错误;
D.标准状况下,乙酸乙酯不是气体,因此无法计算物质的量及所含氧原子数,故D错误;
故选A.
点评 本题考查阿伏伽德罗常数的计算与判断,题目难度中等,涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系.


科目:高中化学 来源: 题型:解答题
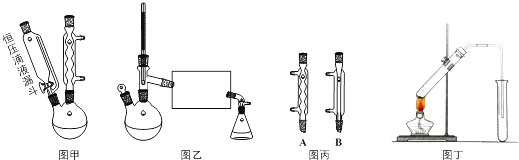
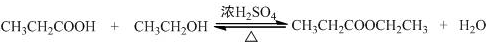 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

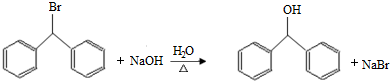 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素含氧酸的酸性随核电荷数的增加而增强 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、K+、Ca2+半径逐渐减小 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2═2H2O△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com