
| A. | 青铜、碳素钢和石英都是合金 | |
| B. | 陶瓷、玻璃和水泥都是无机非金属材料 | |
| C. | 乙醇与乙醛互为同分异构体,都能发生银镜反应 | |
| D. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 |
科目:高中化学 来源: 题型:选择题

| A. | 图1的目的是检验装置的气密性 | |
| B. | 图2中分液漏斗振荡静置后,上层液体颜色变浅 | |
| C. | 图3中电流计的指针不发生偏转 | |
| D. | 图4液态水分解的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  (立方烷) (立方烷) | D. |  (环辛四烯) (环辛四烯) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ⑤ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
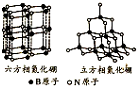 (1)短周期的元素a、b、c、d,原子序数依次增大.a原子的核外电子总数与其电子层数相同,b的基态原子各能级上排布的电子数相同,c的基态原子最高能层有3个未成对电子,d原子的最外层电子数为其内层电子数的3倍.
(1)短周期的元素a、b、c、d,原子序数依次增大.a原子的核外电子总数与其电子层数相同,b的基态原子各能级上排布的电子数相同,c的基态原子最高能层有3个未成对电子,d原子的最外层电子数为其内层电子数的3倍. (填电子式).
(填电子式).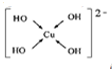 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | 横坐标轴上p点的值为90 | |
| C. | b点时溶质为NaHCO3 | |
| D. | ab段发生反应的离子方程式依次为:CO2+2OH-→H2O+CO32-,CO2+H2O+CO32-→2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
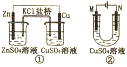
| A. | 装置中盐桥内的K+移向CuSO4溶液 | |
| B. | ①是将电能转变为化学能的装置 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置用于电解精炼钢,溶液中Cu2+的浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com