
| A.此法的优点之一是原料取自大海 |
| B.进行①②③步骤的目的是富集MgCl2 |
| C.可用电解熔融氧化镁的方法制取镁 |
| D.电解法冶炼金属要消耗大量的电能 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.氯化铵加热分解产生NH3 |
| B.硝酸工厂用NH3氧化制NO |
| C.N2与H2合成NH3 |
| D.由NH3和硫酸反应制取硫酸铵 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
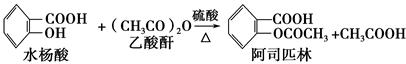
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
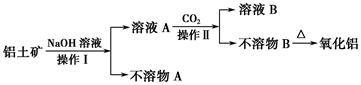
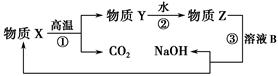
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
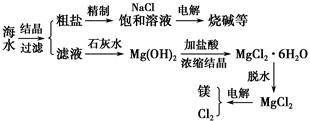
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.蒸馏法淡化海水是将水加热到105 ℃蒸发汽化,然后将蒸气冷凝而得到蒸馏水的方法 |
| B.天然水里一般溶有Ca2+、Mg2+等金属阳离子,我们把溶有较多量Ca2+、Mg2+的水称为硬水 |
| C.阳离子交换树脂中的H+可与水中的金属阳离子Mn+交换 |
| D.阴离子交换树脂中既含有阳离子,又含有阴离子,因此既能与水中的阳离子交换,又能与水中的阴离子交换 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
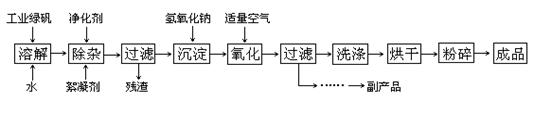
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com