
”¾ĢāÄæ”æŌĖÓĆ»Æѧ·“Ó¦ŌĄķŃŠ¾æµŖ”¢ŃõµČµ„ÖŹ¼°Ęä»ÆŗĻĪļµÄ·“Ó¦ÓŠÖŲŅŖŅāŅ壮
£Ø1£©ŅŃÖŖ£ŗ ![]() O2£Øg£©ØT
O2£Øg£©ØT ![]() O2+£Øg£©+
O2+£Øg£©+ ![]() e©”÷H1=+587.9kJ/mol K1
e©”÷H1=+587.9kJ/mol K1
PtF6£Øg£©+e©ØTPtF6©£Øg£©”÷H2=©771.1kJ/mol K2
O2+PtF6©£Øs£©ØTO2+£Øg£©+PtF6©£Øg£©”÷H3=+482.2kJ/mol K3
Ōņ·“Ó¦O2£Øg£©+PtF6£Øg£©ØTO2+PtF6©£Øs£©µÄ”÷H= £¬ K=£ØÓĆK1”¢K2”¢K3±ķŹ¾£©
£Ø2£©Ņ»¶ØĢõ¼žĻĀ£¬ĢśæÉŅŌŗĶCO2·¢Éś·“Ó¦£ŗFe£Øs£©+CO2£Øg£©FeO£Øs£©+CO£Øg£©£¬ŅŃÖŖøĆ·“Ó¦µÄĘ½ŗā³£ŹżK ÓėĪĀ¶ČT µÄ¹ŲĻµČēĶ¼¼×ĖłŹ¾£® 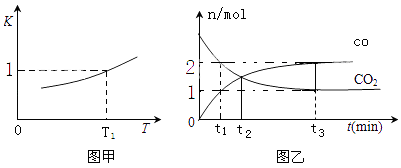
¢ŁT”ę”¢p PaŃ¹ĒæĻĀµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£¬ĻĀĮŠÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ £®
a£®»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ
b£®ČŻĘ÷ÄŚŃ¹Ēæ²»ŌŁ±ä»Æ
c£®vÕż£ØCO2£©=vÄę £ØFeO£©
d£®CO2µÄĢå»ż·ÖŹż²»ŌŁ±ä»Æ
¢ŚT1ĪĀ¶ČĻĀ£¬ĻņĢå»żĪŖVLµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė×ćĮæĢś·Ū²¢³äČėŅ»¶ØĮæµÄCO2 £¬ “ļµ½Ę½ŗāŹ±ŌņCO2µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ£»·“Ó¦¹ż³ĢÖŠĢåĻµµÄÄÜĮæ£ØŌö¶ą»ņ½µµĶ£©
¢ŪT2ĪĀ¶ČĻĀ£¬ŗćČŻĆܱÕČŻĘ÷ÖŠ£¬·“Ó¦¹ż³ĢÖŠ²ā¶ØCOŗĶCO2ĪļÖŹµÄĮæÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ŅŅĖłŹ¾£®ŌņT1T2£ØĢī£¾”¢£¼»ņ=£©£¬CO2µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ £¬ Ę½ŗāŹ±»ģŗĻĘųĢåµÄĆܶČÓėĘšŹ¼Ź±ĘųĢåµÄĆܶČÖ®±ČĪŖ £®
”¾“š°ø”æ
£Ø1£©©77.5kJ/mol£»![]()
£Ø2£©ad£»50%£»Ōö¶ą£»£¾£»66.7%£»25£ŗ33
”¾½āĪö”æ½ā£ŗ£Ø1£©ŅŃÖŖ£ŗ¢Ł ![]() O2£Øg£©ØT
O2£Øg£©ØT ![]() O2+£Øg£©+
O2+£Øg£©+ ![]() e©”÷H1=+587.9kJ/mol K1¢ŚPtF6£Øg£©+e©ØTPtF6©£Øg£©”÷H2=©771.1kJ/mol K2
e©”÷H1=+587.9kJ/mol K1¢ŚPtF6£Øg£©+e©ØTPtF6©£Øg£©”÷H2=©771.1kJ/mol K2
¢ŪO2+PtF6©£Øs£©ØTO2+£Øg£©+PtF6©£Øg£©”÷H3=+482.2kJ/mol K3
øł¾ŻøĒĖ¹¶ØĀÉ£ŗ¢Ł”Į2”Ā¢Ś©¢ŪæɵĆO2£Øg£©+PtF6£Øg£©ØTO2+PtF6©£Øs£©£¬”÷H=©77.5kJ/mol£¬K= ![]() £»
£»
ĖłŅŌ“š°øŹĒ£ŗ©77.5kJ/mol£» ![]() £»£Ø2£©¢ŁFe£Øs£©+CO2£Øg£©FeO£Øs£©+CO£Øg£©£¬·“Ó¦Ē°ŗóŹĒĘųĢåĢå»ż²»±äµÄ·ÅČČ·“Ó¦£¬
£»£Ø2£©¢ŁFe£Øs£©+CO2£Øg£©FeO£Øs£©+CO£Øg£©£¬·“Ó¦Ē°ŗóŹĒĘųĢåĢå»ż²»±äµÄ·ÅČČ·“Ó¦£¬
a”¢·“Ó¦Ē°ŗóĘųĢåĪļÖŹµÄĮæ²»±ä£¬ĘųĢåÖŹĮæ·¢Éś±ä»Æ£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ£¬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬aÕżČ·£»
b”¢·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬ČŻĘ÷ÄŚŃ¹ĒæŹ¼ÖÕ²»·¢Éś±ä»Æ£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬¹Źb“ķĪó£»
c”¢Ńõ»ÆŃĒĢśŹĒ¹ĢĢ壬²»ÄܱķŹ¾·“Ó¦ĖŁĀŹ£¬¹Źc“ķĪó£»
d”¢Ėę×Å·“Ó¦µÄ½ųŠŠ£¬CO2µÄĮæ¼õÉŁ£¬µ±Ģå»ż·ÖŹż²»ŌŁ±ä»Æ“ļĘ½ŗāדĢ¬£¬¹ŹdÕżČ·£»
ĖłŅŌ“š°øŹĒ£ŗad£»
¢ŚT1ĪĀ¶ČĻĀ£¬ĻņĢå»żĪŖV LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė×ćĮæĢś·Ū²¢³äČėŅ»¶ØĮæµÄCO2 £¬ Ę½ŗā³£ŹżĪŖ1£¬É趞Ńõ»ÆĢ¼ĘšŹ¼ĮæĪŖx£¬±ä»ÆĮæĪŖy£¬
Fe£Øs£©+CO2£Øg£©FeO£Øs£©+CO£Øg£©£¬
ĘšŹ¼Įæ x 0
±ä»ÆĮæ y y
Ę½ŗāĮæ x©y y
Ę½ŗā³£ŹżK= ![]() =1£¬½āµĆ
=1£¬½āµĆ ![]() =0.5=50%£»·“Ó¦·ÅČČ£¬·“Ó¦¹ż³ĢĢåĻµÄÜĮæŌö¶ą£»
=0.5=50%£»·“Ó¦·ÅČČ£¬·“Ó¦¹ż³ĢĢåĻµÄÜĮæŌö¶ą£»
ĖłŅŌ“š°øŹĒ£ŗ50%£»Ōö¶ą£»
¢Ūøł¾ŻĶ¼ŅŅ£¬É跓ӦȯĘ÷ČŻ»żĪŖV L£¬ŌņK2= ![]() =2£¬·“Ó¦·ÅČČ£¬»ÆŃ§Ę½ŗā³£ŹżŌö“ó£¬ĖµĆ÷·“Ó¦ĪĀ¶Č½µµĶ£¬T1£¾T2£»T2ĪĀ¶ČĻĀ£¬É跓ӦȯĘ÷ČŻ»żĪŖV L£¬Ę½ŗā³£ŹżĪŖ2£¬É趞Ńõ»ÆĢ¼ĘšŹ¼ĮæĪŖa£¬±ä»ÆĮæĪŖb£¬
=2£¬·“Ó¦·ÅČČ£¬»ÆŃ§Ę½ŗā³£ŹżŌö“ó£¬ĖµĆ÷·“Ó¦ĪĀ¶Č½µµĶ£¬T1£¾T2£»T2ĪĀ¶ČĻĀ£¬É跓ӦȯĘ÷ČŻ»żĪŖV L£¬Ę½ŗā³£ŹżĪŖ2£¬É趞Ńõ»ÆĢ¼ĘšŹ¼ĮæĪŖa£¬±ä»ÆĮæĪŖb£¬
Fe£Øs£©+CO2£Øg£©FeO£Øs£©+CO£Øg£©£¬
ĘšŹ¼Įæ a 0
±ä»ÆĮæ b b
Ę½ŗāĮæ a©b b
Ę½ŗā³£ŹżK= ![]() =2£¬½āµĆ£ŗ
=2£¬½āµĆ£ŗ ![]() =
= ![]() =66.7%£»Ę½ŗāŹ±»ģŗĻĘųĢåµÄĆܶČÓėĘšŹ¼Ź±ĘųĢåµÄĆܶČÖ®±ČĪŖĘųĢåĦ¶ūÖŹĮæÖ®±Č
=66.7%£»Ę½ŗāŹ±»ģŗĻĘųĢåµÄĆܶČÓėĘšŹ¼Ź±ĘųĢåµÄĆܶČÖ®±ČĪŖĘųĢåĦ¶ūÖŹĮæÖ®±Č ![]() £ŗ44=25£ŗ33£»
£ŗ44=25£ŗ33£»
ĖłŅŌ“š°øŹĒ£ŗ£¾£» 66.7%£» 25£ŗ33£®
”¾æ¼µć¾«Īö”æ½ā“š“ĖĢāµÄ¹Ų¼üŌŚÓŚĄķ½ā·“Ó¦ČČŗĶģŹ±äµÄĻą¹ŲÖŖŹ¶£¬ÕĘĪÕŌŚ»Æѧ·“Ó¦ÖŠ·Å³ö»ņĪüŹÕµÄČČĮ棬Ķس£½Š·“Ó¦ČČ£¬ŅŌ¼°¶Ō»ÆŃ§Ę½ŗāµÄ¼ĘĖćµÄĄķ½ā£¬ĮĖ½ā·“Ó¦Īļ×Ŗ»ÆĀŹ=×Ŗ»ÆÅØ¶Č”ĀĘšŹ¼ÅØ¶Č”Į100%=×Ŗ»ÆĪļÖŹµÄĮæ”ĀĘšŹ¼ĪļÖŹµÄĮæ”Į100%£»²śĘ·µÄ²śĀŹ=Źµ¼ŹÉś³É²śĪļµÄĪļÖŹµÄĮæ”ĀĄķĀŪÉĻæɵƵ½²śĪļµÄĪļÖŹµÄĮæ”Į100%£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¾ŹµŃé²ā¶ØijĪŽÉ«ČÜŅŗÖŠŗ¬ÓŠSO42£”¢CO32££¬»¹æÉÄÜŗ¬ÓŠĄė×Ó
A.Ba2+B.H+C.Fe3+D.NH4+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢B”¢DŹĒÓɳ£¼ūµÄ¶ĢÖÜĘŚ·Ē½šŹōŌŖĖŲŠĪ³ÉµÄµ„ÖŹ£¬³£ĪĀĻĀAŹĒµ»ĘÉ«·ŪÄ©£¬B”¢DŹĒĘųĢ壬F”¢G”¢HµÄŃęÉ«·“Ó¦¾łĪŖ»ĘÉ«£¬Ė®ČÜŅŗ¾łĻŌ¼īŠŌ£¬EÓŠĘư׊Ō”£ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·Ö²śĪļ¼°·“Ó¦Ģõ¼žŅŃĀŌČ„£©£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
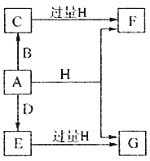
£Ø1£©AĖłŗ¬ŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆĪŖ______________£¬CµÄµē×ÓŹ½ĪŖ_______________”£
£Ø2£©AÓėHŌŚ¼ÓČČĢõ¼žĻĀ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ__________________”£
£Ø3£©½«AČÜÓŚ·ŠĢŚµÄGČÜŅŗÖŠæÉŅŌÖʵƻÆŗĻĪļI£¬IŌŚĖįŠŌČÜŅŗÖŠ²»ĪČ¶Ø£¬Ņ×Éś³ÉµČĪļÖŹµÄĮæµÄAŗĶE£¬IŌŚĖįŠŌĢõ¼žĻĀÉś³ÉAŗĶEµÄĄė×Ó·½³ĢŹ½ĪŖ____________________”£IŹĒÖŠĒ滹Ō¼Į£¬ŌŚ·ÄÖÆ”¢ŌģÖ½¹¤ŅµÖŠ×÷ĪŖĶŃĀČ¼Į£¬ĻņIČÜŅŗÖŠĶØČėĀČĘųæÉ·¢Éś·“Ó¦£¬²Ī¼Ó·“Ó¦µÄIŗĶĀČĘųµÄĪļÖŹµÄĮæ±ČĪŖ1:4£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________________”£
£Ø4£©Ļņŗ¬ÓŠ0.4molF”¢0.1molGµÄ»ģŗĻČÜŅŗÖŠ¼ÓČė¹żĮæŃĪĖį£¬ĶźČ«·“Ó¦ŗóŹÕ¼Æµ½aLĘųĢåC£Ø±ź×¼×“æö£©£¬Č”·“Ó¦ŗó³ĪĒåČÜŅŗ£¬¼ÓČė¹żĮæFeCl3ČÜŅŗ£¬µĆµ½³Įµķ3.2g£¬Ōņa=____________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ĒėÓĆĻĀĮŠ10ÖÖĪļÖŹµÄŠņŗÅĢīæÕ£ŗ
¢ŁO2 ¢ŚH2 ¢ŪNH4NO3 ¢ÜK2O2 ¢ŻBa(OH)2 ¢ŽCH4 ¢ßCO2 ¢ąNaF ¢įNH3 ¢āI2
ĘäÖŠ¼ČÓŠĄė×Ó¼üÓÖÓŠ·Ē¼«ŠŌ¼üµÄŹĒ________£»¼ČÓŠĄė×Ó¼üÓÖÓŠ¼«ŠŌ¼üµÄŹĒ________”£
£Ø2£©X”¢YĮ½ÖÖÖ÷×åŌŖĖŲÄÜŠĪ³ÉXY2ŠĶ»ÆŗĻĪļ£¬ŅŃÖŖXY2ÖŠ¹²ÓŠ38øöµē×Ó£¬ČōXY2ĪŖ³£¼ūŌŖĖŲŠĪ³ÉµÄĄė×Ó»ÆŗĻĪļ£¬Ęäµē×ÓŹ½ĪŖ_________£»ČōXY2ĪŖ¹²¼Ū»ÆŗĻĪļŹ±£¬Ęä½į¹¹Ź½ĪŖ______”£
£Ø3£©ĀČ»ÆĀĮµÄĪļĄķŠŌÖŹ·Ē³£ĢŲŹā£¬Čē£ŗĀČ»ÆĀĮµÄČŪµćĪŖ190”ę£¬µ«ŌŚ180”ę¾ĶæŖŹ¼Éż»Ŗ”£¾Ż“ĖÅŠ¶Ļ£¬ĀČ»ÆĀĮŹĒ________(Ģī”°¹²¼Ū»ÆŗĻĪļ”±»ņ”°Ąė×Ó»ÆŗĻĪļ”±)£¬æÉŅŌÖ¤Ć÷ÄćµÄÅŠ¶ĻÕżČ·µÄŹµŃéŅĄ¾Ż____________________”£
£Ø4£©ĻÖÓŠa~g7ÖÖ¶ĢÖÜĘŚŌŖĖŲ£¬ĖüĆĒŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬Ēė¾Ż“Ė»Ų“šĻĀĮŠĪŹĢā£ŗ
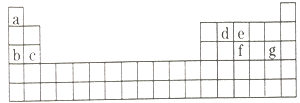
¢ŁŌŖĖŲµÄŌ×Ӽ䷓Ӧ×īČŻŅ׊Ī³ÉĄė×Ó¼üµÄŹĒ________________”£
A.cŗĶf B.bŗĶg C.dŗĶg D.bŗĶe
¢ŚŠ“³öa~g7ÖÖŌŖĖŲŠĪ³ÉµÄĖłÓŠŌ×Ó¶¼Āś×ć×īĶā²ćĪŖ8µē×Ó½į¹¹µÄČĪŅāŅ»ÖÖ·Ö×ӵķÖ×ÓŹ½____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø14·Ö£©Ģ¼”¢µŖ”¢ĮņŹĒ֊ѧ»ÆѧÖŲŅŖµÄ·Ē½šŹōŌŖĖŲ£¬ŌŚ¹¤Å©ŅµÉś²śÖŠÓŠ¹ć·ŗµÄÓ¦ÓĆ”£
(1£©ÓĆÓŚ·¢Éä”°Ģģ¹¬Ņ»ŗÅ”±µÄ³¤Õ÷¶žŗÅ»š¼żµÄČ¼ĮĻŹĒŅŗĢ¬Ę«¶ž¼×ėĀ£ØCH3£©2N£NH2£¬Ńõ»Æ¼ĮŹĒŅŗĢ¬ĖÄŃõ»Æ¶žµŖ”£¶žÕßŌŚ·“Ó¦¹ż³ĢÖŠ·Å³ö“óĮæÄÜĮ棬Ķ¬Ź±Éś³ÉĪŽ¶¾”¢ĪŽĪŪČ¾µÄĘųĢ唣ŅŃÖŖŹŅĪĀĻĀ£¬1 gČ¼ĮĻĶźČ«Č¼ÉÕŹĶ·Å³öµÄÄÜĮæĪŖ42.5kJ£¬ĒėŠ“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½________________________________________”£
£Ø2£©298 KŹ±£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśæÉÄę·“Ó¦£ŗ
2NO2(g)![]() N2O4(g) ¦¤H£½£a kJ”¤mol£1(a£¾0)
N2O4(g) ¦¤H£½£a kJ”¤mol£1(a£¾0)
N2O4µÄĪļÖŹµÄĮæÅضČĖꏱ¼ä±ä»ÆČēĶ¼”£“ļĘ½ŗāŹ±£¬N2O4µÄÅضČĪŖNO2µÄ2±¶£¬»Ų“šĻĀĮŠĪŹĢā”£

¢Ł298kŹ±£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ________”£
¢ŚŌŚĪĀ¶ČĪŖT1”¢T2Ź±£¬Ę½ŗāĢåĻµÖŠNO2µÄĢå»ż·ÖŹżĖęŃ¹Ēæ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

a£®A”¢CĮ½µćµÄ·“Ó¦ĖŁĀŹ£ŗA£¾C
b£®B”¢CĮ½µćµÄĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ£ŗB£¼C
c£®A”¢CĮ½µćĘųĢåµÄŃÕÉ«£ŗAÉī£¬CĒ³
d£®ÓÉדĢ¬Bµ½×“Ģ¬A£¬æÉŅŌÓĆ¼ÓČȵķ½·Ø
¢ŪČō·“Ó¦ŌŚ398K½ųŠŠ£¬Ä³Ź±æĢ²āµĆn(NO2£©="0.6" mol n(N2O4£©=1.2mol£¬Ōņ“ĖŹ±V£ØÕż£© V£ØÄę£©£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©”£
£Ø3£©NH4HSO4ŌŚ·ÖĪöŹŌ¼Į”¢Ņ½Ņ©”¢µē×Ó¹¤ŅµÖŠÓĆĶ¾¹ć·ŗ”£ĻÖĻņ100 mL 0.1 mol”¤L£1NH4HSO4ČÜŅŗÖŠµĪ¼Ó0.1 mol”¤L£1NaOHČÜŅŗ£¬µĆµ½µÄČÜŅŗpHÓėNaOHČÜŅŗĢå»żµÄ¹ŲĻµĒśĻßČēĶ¼ĖłŹ¾”£
ŹŌ·ÖĪöĶ¼ÖŠa”¢b”¢c”¢d”¢eĪåøöµć£¬
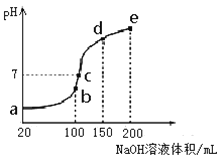
¢ŁĖ®µÄµēĄė³Ģ¶Č×ī“óµÄŹĒ__________£»
¢ŚĘäČÜŅŗÖŠc(OH-)µÄŹżÖµ×ī½Ó½üNH3”¤H2OµÄµēĄė³£ŹżKŹżÖµµÄŹĒ £»
¢ŪŌŚcµć£¬ČÜŅŗÖŠø÷Ąė×ÓÅضČÓɓ󵽊”µÄÅÅĮŠĖ³ŠņŹĒ_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖA”¢B”¢CĪŖ֊ѧ»Æѧ֊³£¼ūµÄµ„ÖŹ”£ŹŅĪĀĻĀ£¬AĪŖ¹ĢĢ壬BŗĶC¾łĪŖĘųĢ唣ŌŚŹŹŅĖµÄĢõ¼žĻĀ£¬ĖüĆĒæÉŅŌ°“ČēĶ¼½ųŠŠ·“Ó¦”£ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ

A. A”¢B”¢CÖŠČżÖÖŌŖĖŲµÄČĪŅāĮ½ÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļĖłŹōĪļÖŹĄą±šæÉÄÜŹĒŃõ»ÆĪļ
B. A”¢B”¢CÖŠČżÖÖŌŖĖŲµÄČĪŅāĮ½ÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļĖłŹōĪļÖŹĄą±šŅ»¶Ø²»ŹĒ¼ī
C. Čē¹ūEČÜŅŗŹĒŅ»ÖÖĒæĖį£¬ŌņEČÜŅŗĪŖĮņĖį
D. A”¢B”¢CÖŠÓŠŅ»ÖÖ½šŹōĒŅĪŖB
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķĪŖŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö”£

£Ø1£©¢ŽŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ___________________________”£
£Ø2£©ŌŚÉĻ±ķŌŖĖŲÖŠ£¬·Ē½šŹōŠŌ×īĒæµÄŹĒ________£ØĢīŌŖĖŲ·ūŗÅ£©”£
£Ø3£©±Č½Ļ¢Ł”¢¢ŻµÄŌ×Ó°ė¾¶ŗĶĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗŌ×Ó°ė¾¶Š”µÄŹĒ________£ØĢīŌŖĖŲ·ūŗÅ£©£¬ĘųĢ¬Ēā»ÆĪļøüĪČ¶ØµÄŹĒ______________£ØĢī»ÆѧŹ½£©”£
£Ø4£©¢ŪµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļÓė¢ÜµÄŃõ»ÆĪļ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ£ŗ
_____________________________________________________________________ӣ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com