
| A. | 原子序数:X>Y>Z | B. | 非金属性:X<Y<Z | ||
| C. | 原子半径:X<Y<Z | D. | 原子得电子能力:X>Y>Z |
分析 A、X、Y、Z 三种非金属元素具有相同的电子层数说明X、Y、Z为同一周期,同一周期元素气态氢化物的稳定性逐渐增强;
B、同一周期从左到右非金属性逐渐增强;
C、同一周期从左到右,原子半径逐渐减小;
D、非金属性越强得电子能力越强.
解答 解:A、X、Y、Z 三种非金属元素具有相同的电子层数说明X、Y、Z为同一周期,同一周期元素气态氢化物的稳定性逐渐增强,气态氢化物的稳定性的强弱顺序为:XH3<H2Y<HZ,故原子序数为X<Y<Z,故A错误;
B、同一周期从左到右非金属性逐渐增强,故非金属性为X<Y<Z,故B正确;
C、同一周期从左到右,原子半径逐渐减小,故原子半径X>Y>Z,故C错误;
D、非金属性越强得电子能力越强,所以原子得电子能力:X<Y<Z,故D错误;
故选B.
点评 本题考查了同周期元素性质的递变规律,明确氢化物越稳定,对应元素的非金属性越强为解答本题的突破口.


科目:高中化学 来源: 题型:选择题
| A. | AlCl3为离子化合物 | B. | Mg与Cl形成共价键 | ||
| C. | SiCl4为共价化合物 | D. | K与Mg 形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
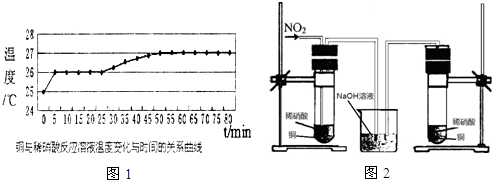
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
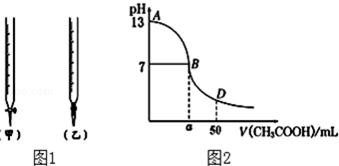
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
| 待测氢氧化钠 | 0.100mol/L醋酸的体积 | ||
| 滴定次数 | 溶液的体积(mL) | 滴定前的刻度(mL) | 滴定后的刻度(mL) |
| 第一次 | 25.00 | 1.68 | 26.89 |
| 第二次 | 25.00 | 0.00 | 27.91 |
| 第三次 | 25.00 | 0.12 | 25.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥氯气 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铝熔点很高,可用于制耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | C | |
| B |
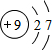 ,C的单质与H2反应的化学方程式为:H2+F2=2HF
,C的单质与H2反应的化学方程式为:H2+F2=2HF查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 235g${\;}_{92}^{235}$U发生裂变反应${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为9NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
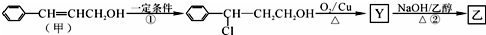
 .1mol乙最多可与5molH2反应.
.1mol乙最多可与5molH2反应.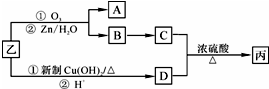
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com