
| A. | 1 mol | B. | 0.75 mol | C. | 0.5 mol | D. | 0.25 mol |
分析 2H2S+SO2=3S↓+2H2O的反应中,H2S中硫元素由-2价→0价生成氧化产物S,二氧化硫中硫元素由+4价→0价生成还原产物S,每生成3molS转移了4mol电子,据此进行解答.
解答 解:硫化氢和二氧化硫的反应为:2H2S+SO2=3S↓+2H2O,H2S中硫元素由-2价→0价生成氧化产物S,二氧化硫中硫元素由+4价→0价生成还原产物S,
当1mol SO2完全反应生成3molS,转移了4mol电子,则反应中转移的电子是1mol生成S的物质的量为:3mol×$\frac{1mol}{4mol}$=0.75mol,
故选B.
点评 本题考查了氧化还原反应的计算,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握电子守恒在氧化还原反应计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190 | -70 |
| 沸点(℃) | 1413 | 1412 | 180 | 57.57 |
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CO32-)>c(HCO3-) | |
| B. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| C. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | c(HCO3-)+2c(CO32-)+c(H2CO3)=1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Cl-、Na+、NO3- | B. | K+ Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Na+、K+、[Al(OH)4]-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
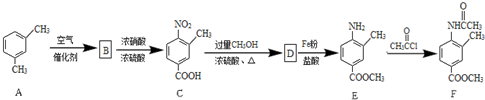
 .
. .
.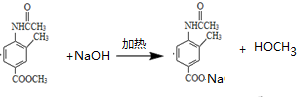 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22p4 | D. | 1s22s22p63s23p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | 只有②④ | C. | 只有①②③ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
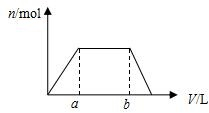 将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )
将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )| A. | 10(b-a)/22.4 mol/L | B. | 20(b-a)/22.4 mol/L | ||
| C. | 10b/22.4 mol/L | D. | 10a/22.4 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com