
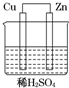
 如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )
如图是Zn和Cu形成的原电池,某实验小组实验后,记录如图所示,描述合理的是 ( )| ①Cu为阳极,Zn为阴极 ②Cu极上有气泡产生 ③SO42-向Cu极移动 ④若有0.5mol电子流经导线,可产生0.25mol气体 ⑤电子的流向是Cu→导线→Zn ⑥正极反应式:Cu+2e-═Cu2+ |
| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
分析 铜、锌、稀硫酸构成的原电池中,较活泼的金属作负极,负极上金属失电子发生氧化反应,较不活泼的金属作正极,正极上氢离子得电子发生还原反应,外电路中,电子从负极沿导线流向正极,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答 解:铜、锌、稀硫酸构成的原电池中,较活泼的金属作负极,负极上金属失电子发生氧化反应,较不活泼的金属作正极,正极上氢离子得电子发生还原反应,外电路中,电子从负极沿导线流向正极,电解质溶液中阳离子向正极移动,阴离子向负极移动.
①反应中失电子的锌作负极,得电子的铜作正极,故错误;
②Cu极为正极上发生2H++2e-=H2↑,有气泡产生,故正确;
③硫酸根离子向锌片移动,故错误;
④由2H++2e-=H2↑可知,有0.5mol电子流向导线,产生氢气0.25mol,故④正确;
⑤导线中电流方向:Cu→导线→Zn,故错误;
⑥正极上氢离子得电子发生还原反应,故错误;
故选B.
点评 本题考查了原电池原理,根据原电池上发生的反应类型、电流的流向等知识来分析解答即可,注意溶液中阴阳离子的移动方向,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 | 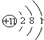 | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 在1L 0.5 mol/L的盐酸加入1.5 mol/L盐酸1L | |
| D. | 从1000mL 1mol/LNaCl溶液中取出100mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,溶液中c(OH-)增大 | |
| D. | 降低温度,溶液中c(NH4+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯的结构简式: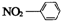 | B. | CO2分子比例模型: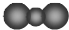 | ||
| C. | HClO的电子式: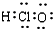 | D. | 中子数为10的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 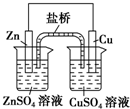 装置中,盐桥(含琼脂的饱和KCl溶液)中的K+移向ZnSO4溶液 | |
| B. | 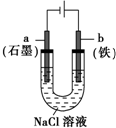 装置通电一段时间后溶液中有红褐色物质产生 | |
| C. | 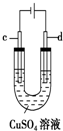 用装置精炼铜时,c极为粗铜 | |
| D. | 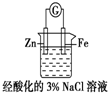 装置中电子由Zn电极沿外电路流向Fe电极,装置中有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com