
下列说法不正确的是
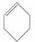 A.
A. 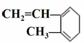 与Br2发生1:1加成反应的产物有5种
与Br2发生1:1加成反应的产物有5种
B.除去苯中 的方法:加溴水,充分振荡,静置分液。
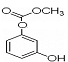 |
C. 1mol 最多能与4mol氢氧化钠反应。
D.采用分子筛固体酸作为苯和丙烯反应的催化剂来制备异丙苯,符合绿色化学工艺。
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
.A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的1/5 |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是 第3周期ⅡA族 ;A与E形成的化合物的电子式是 Mg2+[

 ]2- 。【出处:21教育名师】
]2- 。【出处:21教育名师】
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)F的盐酸盐水溶液呈酸性,原因是 Al3++3H2O Al(OH)3+3H+ (用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是短周期中部分元素的原子半径及主要化合价。
| 元素代号 | U | V | W | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 | 0.143 |
| 主要化合价 | +1 | +1 | -2 | -3 +5 | +2 +4 | +3 |
请回答:
(1)X在元素周期表中的位置是 第二周期ⅤA族 。
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是O2->Na+>Al3+ (用离子符号表示)。用离子方程式表示出Z离子可作净水剂的原因:________________________________________________________________________
________________________________________________________________________。
(3)某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式: Na+[
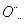
 H]- 。2·1·c·n·j·y
H]- 。2·1·c·n·j·y
(4)1 g YU4气体完全燃烧生成液态水时,放出a kJ的热量,则该反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(5)现有Z与V2W2的固体混合物样品,加入稀盐酸至混合物完全溶解,所得的混合液中c(Z3+)∶c(H+)∶c(Cl-)=1∶2∶8,则原固体混合物中,Z元素与W元素的质量比为 9∶16 (最简整数比)。【来源:21·世纪·教育·网】
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学键与晶体结构的说法正确的是
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A.对羟基苯甲酸的沸点比邻羟基苯甲酸高,冰中既存在范德华力,又存在氢键
B.简单立方是非密置层三维堆积形成的,面心立方是由密置层三维堆积形成的
C.所有共价键都有方向性,形成氢键的三个相关原子可以不在直线上
D.金属晶体的导电、导热性都与自由电子有关,离子晶体在一定条件下可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃。某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去)。
(1)仪器a的名称为 。
(2)用化学反应方程式表示上述制备乙烯的原理 。
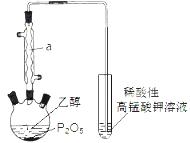 (3)已知P2O5是一种酸性干燥剂,吸水放出大量热,在实验过程中P2O5与乙醇能发生作用,因反应用量的不同,会生成不同的磷酸酯,它们均为易溶于水的物质,沸点较低。写出乙醇和磷酸反应生成磷酸二乙酯的化学方程式(磷酸用结构式表示为
(3)已知P2O5是一种酸性干燥剂,吸水放出大量热,在实验过程中P2O5与乙醇能发生作用,因反应用量的不同,会生成不同的磷酸酯,它们均为易溶于水的物质,沸点较低。写出乙醇和磷酸反应生成磷酸二乙酯的化学方程式(磷酸用结构式表示为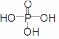 )
)
。
(4)该装置中还缺一种必备仪器,该仪器为 。某同学认为即使添加了该仪器上述装置验证产生了乙烯不够严密,仍须在酸性高锰酸钾溶液之前添加洗气装置,其理由为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
医院里检测糖尿病的方法病人尿液加入到CuSO4和NaOH的混合液中,加热后产生红色沉淀说明病人的尿液中含有
A、脂肪 B、乙酸 C、葡萄糖 D、蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
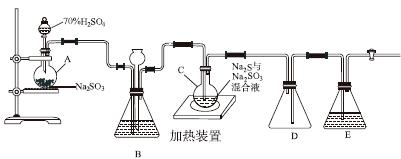
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O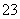 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com