
| A. | NaOH | B. | NH3 | C. | CH3COONa | D. | NH4Cl |
分析 A.氢氧化钠是强碱溶解后全部电离;
B.氨气溶于水生成一水合氨是一元弱碱,溶液中电离出氢氧根离子;
C.醋酸钠是强碱弱酸盐,醋酸根离子水解溶液显碱性;
D.氯化铵溶液中铵根离子水解结合水电离出的氢氧根离子促进水的电离平衡正向进行,溶液显酸性;
解答 解:A.氢氧化钠是强碱溶解后全部电离,溶于水溶液显碱性,故A错误;
B.氨气溶于水生成一水合氨是一元弱碱,溶液中电离出氢氧根离子溶液显碱性,NH3+H2O?NH3•H2O?NH4++OH-,故B错误;
C.醋酸钠是强碱弱酸盐,醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,故C错误;
D.氯化铵溶液中铵根离子水解结合水电离出的氢氧根离子促进水的电离平衡正向进行,NH4++H2O?NH3•H2O+H+,溶液显酸性,故D正确;
故选D.
点评 本题考查了盐类水解的原理,溶液酸碱性的分析判断,掌握基础是解题关键,题目较简单.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液,先产生白色沉淀,后迅速变为灰绿色,最后变为红褐色,一定有Fe2+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入硝酸银溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解,一定有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L一氧化碳和二氧化碳混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1克氯气与足量的氢氧化钠溶液反应转移的电子数位0.2NA | |
| C. | 92克二氧化氮和四氧化二氮的混合气体中含有的原子总数为6NA | |
| D. | 1.5mol/L氯化钙溶液中含有氯离子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定中涉及的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | KMnO4标准溶液常用硫酸酸化,若用HNO3酸化,会使测定结果偏低 | |
| C. | KMnO4标准溶液盛放在酸式滴定管中 | |
| D. | 该实验选择酚酞做指示剂,当待测液颜色由无色变为浅红色时即达到滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-═BaSO4↓+H2O | |
| B. | 将稀硝酸滴加到氯化银固体上:AgCl+H+═Ag++HCl | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3•H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
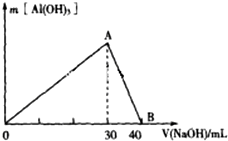 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量氨水与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝溶于稀盐酸中:H++OH-═H2O | |
| C. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 过量氢氧化钠溶液与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com