
| 乙醇 | 溴乙烷 | 1-丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
分析 (1)用乙醇与溴化钠以及浓硫酸加热可制得溴乙烷;
(2)浓硫酸具有强氧化性,能氧化溴离子为溴单质,易发生消去反应,浓硫酸溶解溶液温度升高易使溴化氢挥发;
(3)根据题给信息知,1-溴丁烷和正丁醇的沸点相差较小,不能采用蒸馏的方法分离;
(4)根据溴代烷在碱溶液中水解,碘化钠和溴单质反应生成碘单质,氯化钠不能除去溴单质进行判断;
(5)根据平衡移动原理分析采用边反应边蒸出产物的原因;根据1-溴丁烷和正丁醇的沸点的沸点大小判断.
解答 解:(1)用乙醇与溴化钠以及浓硫酸加热可制得溴乙烷,反应方程式为2CH3CH2OH+2NaBr+H2SO4$\stackrel{△}{→}$2CH3CH2Br+2H2O+Na2SO4,
故答案为:2CH3CH2OH+2NaBr+H2SO4$\stackrel{△}{→}$2CH3CH2Br+2H2O+Na2SO4;
(2)1-溴丁烷和水不能形成氢键所以不易溶于水,且密度大于水,所以将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层,
故答案为:下层;
(3)a.浓硫酸和1-丁醇反应发生副反应消去反应生成烯烃、分子间脱水反应生成醚,稀释后不能发生类似反应减少副产物烯和醚的生成,故a正确;
b.浓硫酸具有强氧化性能将溴离子氧化为溴单质,稀释浓硫酸后能减少Br2的生成,故b正确;
c.反应需要溴化氢和1-丁醇反应,浓硫酸溶解溶液温度升高,使溴化氢挥发,稀释后减少HBr的挥发,故c正确;
d.水是产物不是反应的催化剂,故d错误;
故选abc;
(4)欲除去溴代烷中的少量杂质Br2,
a.NaI和溴单质反应,但生成的碘单质会混入,故a错误;
b.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液中水解反应,故b错误;
c.溴单质和NaHSO3 溶液发生氧化还原反应,可以除去溴单质,故c正确;
d.KCl不能除去溴单质,故d错误;
故答案为:c;
(5)根据题给信息知,乙醇和溴乙烷的沸点相差较大,采用边反应边蒸出产物的方法,可以使平衡向生成溴乙烷的方向移动,而1-溴丁烷和正丁醇的沸点相差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出,所以不能边反应边蒸出产物,
故答案为:平衡向生成溴乙烷的方向移动;1-溴丁烷和正丁醇的沸点相差不大.
点评 本题考查了制备实验方案的设计,明确物质的性质及实验原理是设计实验的前提,同时考查了学生分析问题、解决问题的能力,本题难度中等.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
 化工厂生产盐酸的主要过程是:
化工厂生产盐酸的主要过程是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D、E进行焰色反应均显黄色,这些物质能实现如图所示的转化关系.其中A为淡黄色固体,C为强碱.
A、B、C、D、E进行焰色反应均显黄色,这些物质能实现如图所示的转化关系.其中A为淡黄色固体,C为强碱.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
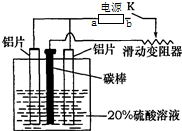 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白:
铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中加入AgNO3溶液得白色沉淀,加稀盐酸不消失,可能存在Cl-或SO42- | |
| B. | 无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸不溶解,则一定含有SO42- | |
| C. | 用CCl4萃取碘水中的碘,下层呈紫红色 | |
| D. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、MnO4- | B. | Fe2+、Ba2+、Cl-、SO42- | ||
| C. | Na+、K+、Cu2+、NO3- | D. | NO3-、SO42-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com