
【题目】2017年11月16日新闻报道“阿斯利康哮喘”新药获批上市,哮喘率降低近51%,有机物Z可用于治疗哮喘、系统性红斑狼疮等。其合成路线如下图所示
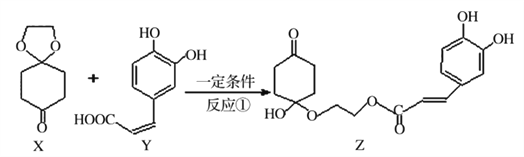
(1)化合物X的有_______种化学环境不同的氢原子。
(2)下列说法正确的是_______.
A.X是芳香化合物 B.Ni催化下Y能与5molH2加成
C.Z能发生加成、取代及消去反应 D. lmolZ最多可与5molNaOH反应
(3)Y与过量的溴水反应的化学方程式为_________。
(4)X可以由_______(写名称)和M(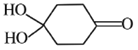 ) 分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N (分子式为C6H8O2),则N的结构简式为_____(己知烯醇式不稳定,会发生分子重排,例如:
) 分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N (分子式为C6H8O2),则N的结构简式为_____(己知烯醇式不稳定,会发生分子重排,例如: 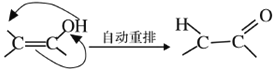 )。
)。
(5)Y也可以与环氟丙烷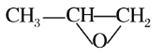 )发生类似反应①的反应,其生成物的结构简式为_________(写一种);Y的同分异构体很多种,其中有苯环、苯环上有二个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有_____种。
)发生类似反应①的反应,其生成物的结构简式为_________(写一种);Y的同分异构体很多种,其中有苯环、苯环上有二个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有_____种。
(6) 可由
可由 和有机物H分子间脱去一分子水而得,则H的名称为________;通常采用
和有机物H分子间脱去一分子水而得,则H的名称为________;通常采用![]() 为原料合成
为原料合成 ,请参照题目路线图设计该合成路线(无机试剂任选) _______。(合成路线常用的表示方式为:
,请参照题目路线图设计该合成路线(无机试剂任选) _______。(合成路线常用的表示方式为:  )
)
【答案】 3 C  乙二醇
乙二醇 
 或
或 8 乙二醇
8 乙二醇 
【解析】(1)根据化合物X的结构简式得出有3种不同化学环境的氢原子。
(2)C项,Z中含有碳碳双键和苯环,可以发生加成反应,含有酚羟基,能发生取代反应,醇羟基连接的碳原子的邻位碳上有氢原子,能发生消去反应,故C项正确;A项,X中没有苯环,不是芳香化合物,故A项错误;
B项,Y中苯环消耗3molH2,碳碳双键消耗1molH2,所以Y可与4molH2发生加成反应,故B项错误;D项,Z中含有酚羟基和酯基,最多可与3molNaOH反应,故D项错误。
综上所述,本题正确答案为C。
(3)酚羟基激活苯环邻位和对位上的氢与溴发生取代反应,碳碳双键与溴发生加成反应,所以Y与过量的溴水反应的化学方程式为 。
。
(4)根据X的结构简式推出M与乙二醇分子间脱水制备得到X,M中醇羟基连接的碳原子的邻位碳上有氢原子,能发生消去反应,发生1个-OH的消去反应得到烯醇式结构,根据材料知烯醇式不稳定发生重排,生成稳定化合物N,则N的结构简式为![]() 。
。
(5)根据反应①,Y与环氧丙烷(![]() )发生反应,其生成物的结构简式为
)发生反应,其生成物的结构简式为 或
或  ;苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的取代基有4种:
;苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的取代基有4种:![]() 、
、![]() 、
、![]() 、
、![]() (或
(或 ),苯环上取代基的位置有2种可能
),苯环上取代基的位置有2种可能 ,所以Y的同分异构体8种。
,所以Y的同分异构体8种。
(6)![]() 可由
可由![]() 和有机物H分子间脱去一分子水而得,根据原子守恒和碳架结构不变,可知H的结构简式为HOCH2CH2OH,名称为乙二醇;采用
和有机物H分子间脱去一分子水而得,根据原子守恒和碳架结构不变,可知H的结构简式为HOCH2CH2OH,名称为乙二醇;采用![]() 为原料合成
为原料合成![]() 的流程为
的流程为 。
。


科目:高中化学 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的400mL 0.1molL﹣1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100mL,则NaOH 溶液的浓度为( )
A. 0.1 molL﹣1 B. 0.2 molL﹣1 C. 0.4 molL﹣1 D. 0.8 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是自然界中形成化合物种类最多的元素,CO和CO2是碳的最常见氧化物。
(1)研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2,其过程如图1所示。过程①的化学方程式是______。在过程②中每产生0.1molO2,转移电子______mol。

(2)在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJmol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
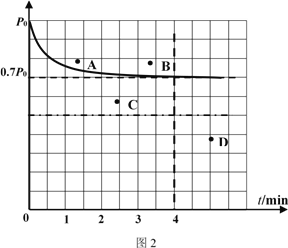
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2,控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为______;温度T1 下,该反应的化学平衡常为______。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是______(填字母)。
(3)工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
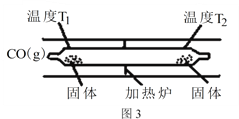
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池,某种锂离子电池的结构示意图如下,它在放电时有关离子转化关系如图所示,下列说法正确的是

A. Li+透过膜除允许Li+通过外,还允许H2O分子通过
B. 充电时,电池内部发生的总反应为Li++Fe2+![]() Li+Fe3+
Li+Fe3+
C. 充电时,钛电极与外电源的负极相连
D. 放电时,进入贮罐的液体发生的离子反应方程式为:S2O82-+Fe2+=Fe3++2SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃~60℃的两个原因除了加快反应速率外,还有___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
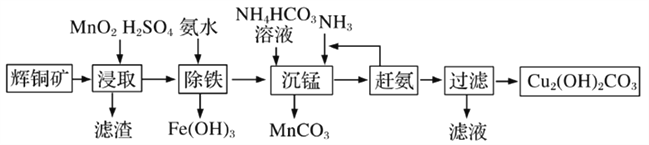
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式___________。
③写出“沉锰”反应时离子方程式___________。
④“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。

(1)往A溶液中分别滴入几滴KSCN溶液,溶液的颜色__________,
(2)根据上述过程写出有关反应的离子方程式:Fe3O4→A _________________,A→B ___________。
(3)向B溶液中加入NaOH溶液,可看到的现象是_______________________________________,此过程中发生的氧化还原反应化学方程式为__________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是
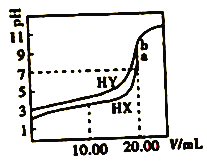
A. 水解常数:X->Y-
B. a、b两点溶液混合后:c(HX)+c(HY)+c(H+)=c(OH-)
C. pH=7时,c(Y-)>c(X-)
D. 10.00mlL时,有c(Na+)>c(HX)>c(X-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。

下列说法不正确的是
A. Fe3+对该反应有催化作用
B. 该过程中的Fe3+可由Fe(NO3)3提供
C. 可用K3[Fe(CN)6]溶液区分Fe3+与Fe2+
D. 制备CuCl2的总反应为2Cu + O2 + 4HCl = 2CuCl2 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)将35.2铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为_____L,NO2的体积为______L。
(2)参加反应的硝酸的物质的量是_______mol。
(3)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___________mol/L。(结果不需化简)
(II)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为10 g,求
(1)此混合物中CO和CO2物质的量之比_____。
(2)CO的质量分数_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com