
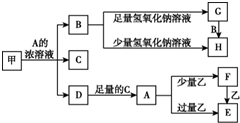
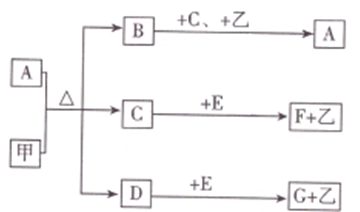
 中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体(图中部分产物和反应条件已略去).分析 D是红棕色气体,说明D是NO2,甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,D与C反应得到A,则B是CO2,C是H2O.二氧化碳和足量氢氧化钠溶液反应生成碳酸钠和水,而二氧化碳和少量氢氧化钠溶液反应生成碳酸氢钠和水,所以G是碳酸钠,而H是碳酸氢钠.乙是生活中常见的金属单质,硝酸和少量乙反应生成F,和过量乙反应生成E,F和乙又可生成E,可知乙为金属铁,而F为硝酸铁,E为硝酸亚铁.
解答 解:D是红棕色气体,说明D是NO2,甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,D与C反应得到A,则B是CO2,C是H2O.二氧化碳和足量氢氧化钠溶液反应生成碳酸钠和水,而二氧化碳和少量氢氧化钠溶液反应生成碳酸氢钠和水,所以G是碳酸钠,而H是碳酸氢钠.乙是生活中常见的金属单质,硝酸和少量乙反应生成F,和过量乙反应生成E,F和乙又可生成E,可知乙为金属铁,而F为硝酸铁,E为硝酸亚铁.
(1)G的名称为碳酸钠,F的化学式为Fe(NO3)3,
故答案为:碳酸钠;Fe(NO3)3;
(2)甲与A的浓溶液反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)碳酸氢钠加热分解为碳酸钠,除去G(碳酸钠)固体中含有H(碳酸氢钠)的杂质采用的方法是加热,
故答案为:加热;
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐硝酸铵,该盐的溶液呈酸性,其原因是:NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
(5)由硝酸铁转化为硝酸亚铁的离子方程式:2Fe3++Fe=3Fe2+,硝酸铁溶液加热,促进铁离子水解彻底进行,得到氢氧化铁彻底,灼烧时氢氧化铁分解,最终所得固体物质的化学式为:Fe2O3,
故答案为:2Fe3++Fe=3Fe2=; Fe2O3.
点评 本题考查无机物的推断,物质的颜色及转化中特殊反应为推断突破口,熟练掌握元素化合物的性质.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:实验题
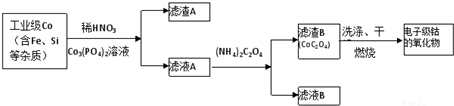
| 开始沉淀的pH | 完全溶解的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
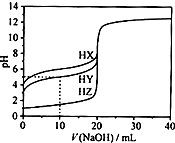 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的酸性强弱顺序:HZ<HY<HX | |
| B. | HZ、HY、HX均为弱酸 | |
| C. | 向HY溶液中加入10.00mLNaOH溶液,一定有c(Y-)+c(OH-)═c(H+)+c(Na+) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的三倍 |
| Z | Z的基态原子价电子排布为nsn-1 |
| W | W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
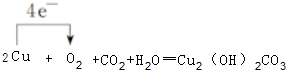 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
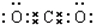 .
.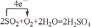 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3NA电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
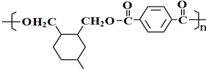
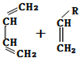 →
→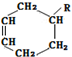 (或写成
(或写成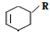 R代表取代基或氢)
R代表取代基或氢)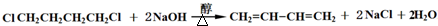 ;
;
 ;
;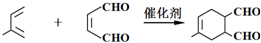 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. HSO3-+OH-(用离子方程式表示).
HSO3-+OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42g乙烯和丙烯的混合气体中碳原子数目一定为3NA. | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入 0.1 mol Cu(OH)2能使溶液复原,则电解时产生标准状况下1.12L的气体 | |
| C. | 配制一定物质的量浓度的NaOH溶液,把NaOH固体于烧杯中充分溶解,并迅速转移到容量瓶中定容 | |
| D. | 30g的NO与O2于密闭容器中充分反应,容器内的气体分子数为1 NA. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com