
| A. | AgCl沉淀生成和溶解同时在不断进行,且速率相等 | |
| B. | AgCl难溶于水,则溶液中没有Ag+和Cl- | |
| C. | 只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成 | |
| D. | 向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
分析 A.AgCl的溶解平衡为动态平衡,生成和溶解速率相等;
B.氯化银在溶液中才溶解平衡,则溶液中一定含有银离子和氯离子;
C.依据溶液中存在沉淀溶解平衡,加入氯离子影响平衡的移动分析;
D.沉淀转化为溶解度更小的物质容易发生.
解答 解:A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,是动态平衡,速率相等且不为零,故A正确;
B.AgCl难溶于水,溶解度很小,但是不为零,所以溶液中含有少量的Ag+和Cl-,故A错误;
C.向AgCl溶液中加入盐酸,若能导致氯离子浓度增大,沉淀溶解平衡逆向进行,会析出AgCl固体,若盐酸浓度很小,导致氯离子浓度减小,就不会生成沉淀,故C错误;
D.沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入NaBr溶液,白色AgCl沉淀转化为淡黄色的AgBr沉淀,故D错误;
故选A.
点评 本题主要考查了沉淀溶解平衡及其影响因素,题目难度不大,明确溶解平衡的实质及其影响因素为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 氧化铝、氧化铁均为两性氧化物 | |
| B. | 氧化铝中的微粒半径:r(Al3+)>r(O2-) | |
| C. | 在该反应中,铝的还原性强于铁的还原性 | |
| D. | 1mol 氧化铁参加反应转移电子数约为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下:
某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
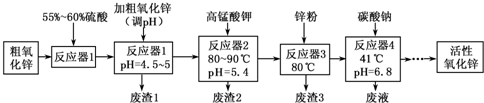
| Fe(OH)2 | Fe( OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
| 开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
| 沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2gO2、O3组成的混合物中含有的质子数为1.6NA | |
| B. | 当反应6HCl+KClO3═Cl2↑+KC1+3H2O有71gC l2生成时,转移电子数目为2NA | |
| C. | 1molC2H4分子中含共用电子对的数自为5NA | |
| D. | 0.1mol乙醇与足量乙酸充分反应后,生成的水分子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为测定Na2S2O3•5H2O产品纯度,准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol•L?1碘的标准溶液滴定. 反应原理为:2S2O32?+I2=S4O62-+2I?
为测定Na2S2O3•5H2O产品纯度,准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol•L?1碘的标准溶液滴定. 反应原理为:2S2O32?+I2=S4O62-+2I?查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 拉瓦锡研究了空气的成分,让大家认识了氧气 | |
| B. | 图为雾霾的主要成分示意图,汽车尾气的大量排放是造成雾霾天气的人为因素之一 | |
| C. | “滴水石穿、绳锯木断、落汤螃蟹着红袍”均不包含化学变化 | |
| D. | “看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4 | B. | c(H+)=0.001 mol•L-1 | ||
| C. | c(OH- )=1×10-11 mol•L-1 | D. | c(H+):c(OH- )=1×104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com