
| A、氢气与氯气见光发生爆炸,说明氢气与氯气具有的总能量小于氯化氢 |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色物质生成且能溶于浓硝酸 |
| C、由于碳燃烧时放出大量的热,所以碳与氧气的反应不需要任何条件 |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、核裂变是一种化学变化 |
| B、131I 与127I互为同素异形体 |
| C、131I 原子的中子数为78 |
| D、碘在周期表中位于第四周期ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
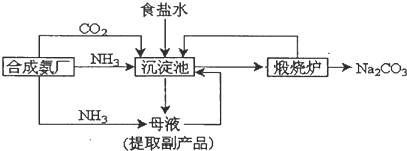
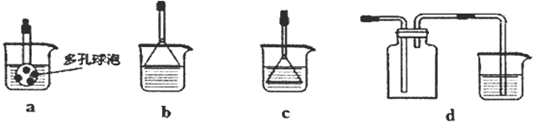
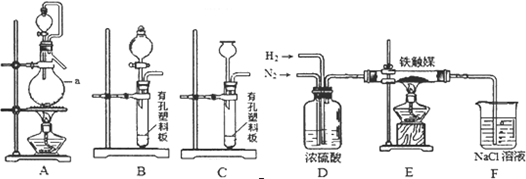
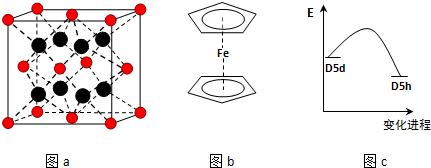
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同质量的Na2CO3和NaHCO3与足量盐酸作用时,碳酸氢钠反应速率更快,产生的气体质量相同 |
| B、NaHCO3俗名:小苏打.Na2CO3俗名:大苏打 |
| C、Na2CO3和NaHCO3均可与澄清石灰水反应 |
| D、Na2CO3和NaHCO3均可与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、VA=0.5mol/(L.min) |
| B、VB=0.3mol/(L.min) |
| C、Vc=2.4mol/(L.min) |
| D、VD=1mol/(L.min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将纳米Fe3O4分散在水中没有丁达尔现象 |
| B、将纳米Fe3O4分散在水中Fe3O4不能透过滤纸 |
| C、每生成1 mol Fe3O4反应转移的电子数为4 NA |
| D、反应物OH-的化学计量数x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | ||||
| B、钠与水的反应:2Na+2H2O═2 Na++2OH-+H2↑ | ||||
| C、稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | ||||
D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定温度下,AgBr水溶液中c(Br-)和c(Ag+)的乘积是一个常数 |
| B、AgBr水溶液的导电能力很弱,所以AgBr为弱电解质 |
| C、室温下,AgBr在纯水中的溶解度大于在KBr溶液中的溶解度 |
| D、向饱和AgBr悬浊液中加入盐酸c(Br-)增大,Ksp值变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com