
 (1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为
(1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为| △c |
| △t |
| △c |
| △t |
| 6-2 |
| 2 |
 ,故答案为:升温;减小SO3浓度;
,故答案为:升温;减小SO3浓度; .
.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H+(aq) + OH-(aq) = H2O(l) △H =-57.3 kJ·mol-1。
对于下列反应:
①HCl(aq) + NH3·H2O(aq) = NH4Cl(aq) + H2O(l) △H=-a kJ·mol-1
②HNO3(aq) + KOH(aq) = KNO3(aq) + H2O(l) △H =-b kJ·mol-1[
则a、b的大小关系为
A.a>b B.b>a C.a = b D.无法比较
查看答案和解析>>
科目:高中化学 来源:2013届广东省广州市高二上学期期中考试化学(理)试卷 题型:填空题
(1)对于下列反应:2SO2
+ O2 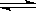 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
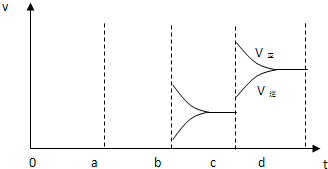
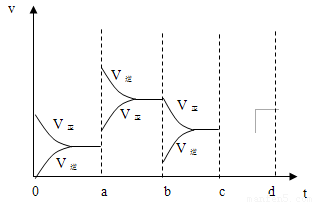
(2)下图表示在密闭容器中反应:2SO2+O2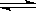 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
;b c过程中改变的条件可能是
; 若增大压强时,反应速度变化情况画在c~d处.
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
;b c过程中改变的条件可能是
; 若增大压强时,反应速度变化情况画在c~d处.
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com